Définitions
La biovigilance, mise en place par le décret n°2003-1206 du 12 décembre 2003, a pour objet la surveillance des incidents et des risques d'incidents relatifs aux éléments et produits du corps humain tels les organes, les tissus, les cellules et le lait maternel utilisés à des fins thérapeutiques, et aux produits, autres que les médicaments, qui en dérivent, aux dispositifs médicaux les incorporant et aux produits thérapeutiques annexes, ainsi que des effets indésirables résultant de leur utilisation.
On entend par incident tout incident lié aux activités entrant dans le champ de compétence de la biovigilance, dû à un accident ou à une erreur, susceptible d'entraîner un effet indésirable chez le patient, le donneur vivant ou le receveur (exemple : découverte d’une tumeur chez le donneur dont au moins un organe a été greffé, contamination mycologique du liquide de conservation). Un incident grave est un incident susceptible d'entraîner des effets indésirables graves.
On entend par effet indésirable toute réaction nocive survenant chez un patient, un donneur vivant ou un receveur, liée ou susceptible d'être liée à un produit ou à une activité entrant dans le champ de la biovigilance (exemple : décès en per-opératoire ou péri-opératoire, infections bactérienne, virale, fongique, parasitaire potentiellement transmise par le greffon).
Un effet indésirable grave est un effet indésirable susceptible d'entraîner la mort ou de mettre la vie en danger, d'entraîner une invalidité ou une incapacité, ou de provoquer ou de prolonger une hospitalisation ou tout autre état morbide, ou susceptible de se reproduire chez un ou plusieurs patients, donneurs vivants ou receveurs.
Dispositif de biovigilance
L’ANSM est l’autorité compétente en matière de biovigilance (Art. R-1211-33 du code de la santé publique (CSP), http://www.ansm.sante.fr/). Pour assurer le bon fonctionnement du système national de biovigilance, l'ANSM s'appuie sur un réseau de structures qui inclut notamment l’Agence de la biomédecine (Art. R-1211-32 du CSP), d’établissements de santé et de correspondants locaux de biovigilance (CLB) dont les missions sont définies réglementairement (Art. R.1211-42 à R.1211-45 du CSP). L’Agence de la biomédecine dispose également d’un correspondant local de biovigilance.
Le CLB de l’Agence de la biomédecine est destinataire de l’ensemble des signalements de biovigilance et des éléments d’informations qui s’y rapportent (Art. R-1211-42 du CSP). L’Agence de la biomédecine joue un rôle important en ce qui concerne le recueil, le traitement, la gestion et l’analyse des signalements et des déclarations des événements indésirables relevant de la biovigilance dans le champ des organes ainsi qu’en matière de gestion des risques (revue analytique des cas signalés en biovigilance en commission interne de vigilance, rappel de la réglementation et des recommandations, outils d’exploitation, rédaction de recommandations professionnelles).
Les questions de sécurité sanitaire et de biovigilance organes sont traitées au sein de la commission de vigilance interne à l’Agence de la biomédecine (COVI), qui analyse à la fois les signalements d’incidents et d’effets indésirables (tels que définis dans l’article R1211-31 du CSP) concernant la sécurité des greffons transmises à l’ANSM et les autres événements indésirables hors champ du dispositif réglementaire de biovigilance qui ne répondent pas aux critères de signalement à l’ANSM.
Matériel et méthodes
Les incidents et les effets indésirables ont fait l’objet d’une déclaration de biovigilance par le CLB de l’Agence de la biomédecine ou celui-ci en a été informé par les CLB de l’établissement conformément aux modalités définies aux articles R.1211-42 et R.1211- 46 du code de la santé publique.
Résultats
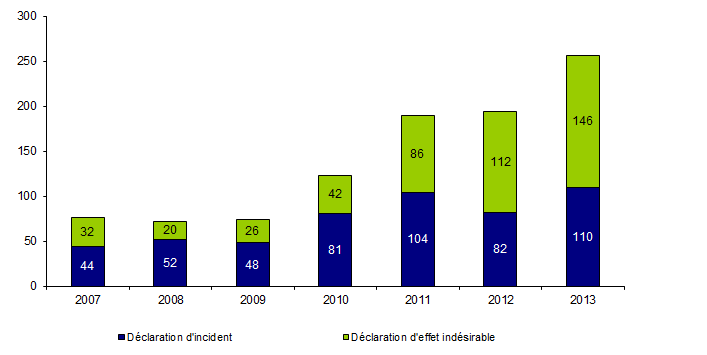
Le nombre de déclaration d’incidents et d’effets indésirables déclarés en 2013 par le dispositif de biovigilance et concernant le prélèvement et la greffe d’organes est de 256 (versus 194 en 2012). Les déclarations se répartissent en 110 déclarations d’incidents et 146 déclarations d’effets indésirables (Figure BIOV1). Il convient également de noter que 1230 liquides de conservation contaminés (bactéries et/ou agents fongiques) ont été comptabilisés.
Des informations complémentaires sont disponibles dans le rapport annuel de synthèse de biovigilance – Agence de la biomédecine 2013 (site des professionnels : http://www.agence-biomedecine.fr/Biovigilance)
Nombre de déclarations de biovigilance relatives à des évènements dans le domaine du prélèvement et de la greffe d’organes survenus en 2013
Figure BIOV1. Evolution du nombre de déclarations d’incidents et d’effets indésirables (2007-2013)
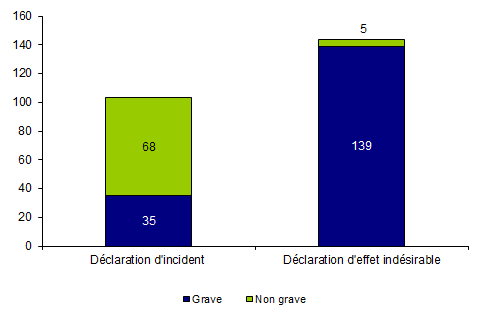
Les évènements indésirables graves1 (G3, G4, G5) correspondent à 70% des déclarations en 2013 (Tableau BIOV1).
Tableau BIOV1. Distribution des déclarations d’incidents et d’effets indésirables en fonction de la gravité
|
Mineure |
Significative |
Grave |
Critique |
Catastrophique |
|
Gravité |
Gravité 1 |
Gravité 2 |
Gravité 3 |
Gravité 4 |
Gravité 5 |
Total |
N |
65 |
9 |
23 |
90 |
60 |
247* |
% |
26,3% |
3,6% |
9,3% |
36,4% |
24,3% |
100% |
⃰ La gravité n’a pas été évaluée pour 6 incidents et pour 2 effets indésirables
La gravité est fonction des conséquences qu’entraîne l’incident ou l’effet indésirable.
Figure BIOV2. Nombre de déclaration d’incidents et d’effets indésirables en fonction de la gravité (n=247, 2013)
Principales déclarations d’incidents au cours de l’année 2013
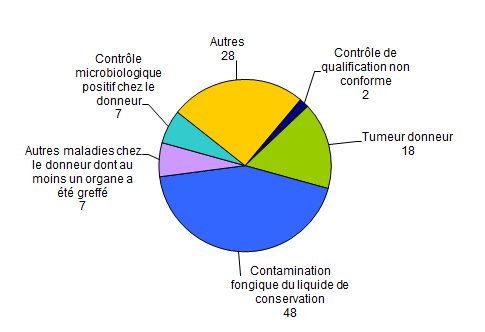
On dénombre (Figure BIOV3) :
- 18 déclarations de tumeur chez un donneur dont au moins un organe a été greffé. Ces tumeurs se répartissent en 11 tumeurs rénales, 1 tumeur du pancréas, 2 tumeurs de la prostate, 2 tumeurs de la thyroïde, 1 tumeur surrénalienne, 1 tumeur du cerveau ;
- 7 déclarations d’autres maladies chez le donneur dont au moins un organe a été greffé;
- 2 déclarations de contrôle de qualification non conforme ;
- 7 déclarations de contrôle microbiologique positif chez le donneur ;
- 48 déclarations d’incidents relatifs à au moins une contamination fongique du liquide de conservation associée ou non à une contamination bactérienne (une déclaration d’incident peut correspondre à plusieurs liquides de conservation positif à agents fongiques ou agents fongiques et bactéries)
Il convient d’ajouter qu’un bilan détaillé des incidents « liquide de conservation contaminés » par des micro-organismes (bactéries ou agents fongiques) a été réalisé :
- Sur les 1230 liquides de conservation contaminés, on dénombre :
- 1225 liquides de conservation contaminés sans effet indésirable grave chez le receveur.
Ils se répartissent en 1139 liquides de conservation positifs à bactéries seules et 86 liquides de conservation positifs à agents fongiques ou agents fongiques et bactéries (correspondant à 48 déclarations). - 5 liquides de conservations contaminés avec effet indésirable grave chez le receveur.
Ils se répartissent en 1 liquide de conservation positif à bactéries seules entrainant un décès (non fonction primaire du greffon sur septicémie à Enterobacter cloacae) et 4 liquides de conservation positifs à agents fongiques/bactéries.
- 1225 liquides de conservation contaminés sans effet indésirable grave chez le receveur.
Figure BIOV3. Nombre de déclarations d’incidents par typologie (n=110, 2013)
Principales déclarations d’effets indésirables au cours de l’année 2013
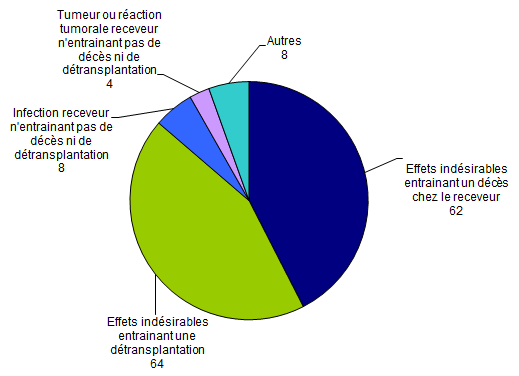
On dénombre (Figure BIOV4) :
- 62 déclarations d’effets indésirables entrainant un décès chez le receveur dont 17 déclarations d’effets indésirables de nature infectieuse2 et 36 déclarations d’effets indésirables de nature cardiaque et vasculaire3;
- 64 déclarations d’effets indésirables entrainant une détransplantation dont 55 déclarations d’effets indésirables de nature cardiaque et vasculaire;
- 4 déclarations liées à une tumeur ou à une réaction tumorale n’entrainant pas de décès ni de détransplantation chez le receveur;
- 8 déclarations d’effets indésirables de nature infectieuse n’entrainant pas de décès ni de détransplantation chez le receveur.
Figure BIOV4. Nombre de déclarations d’effets indésirables par typologie (n=146, 2013)
1 Echelle de gravité :
G1 – mineure : diminution de la performance du processus, sans conséquence sur son résultat, et/ou source de contrainte opérationnelle acceptable.
G2 – significative : dégradation de la performance du processus susceptible ou ayant altéré de façon tolérable son résultat et/ou source de contrainte opérationnelle non acceptable.
G3 – grave :
- dégradation de la performance du processus ayant altéré de façon intolérable son résultat.
- complication modérée lié à la greffe
- risque de transmission d’affection(s) à morbidité modérée accessibles à un traitement
G4 – critique :
- complications sévères liées à la greffe
- risque de transmission par le greffon d’affection(s) à morbidité sévère : cancer, affections transmissibles mortelles à long terme
G5 – catastrophique : décès lié au processus de greffe
2 Exemples : choc septique, septicémie…
3 Exemples : hémorragie, thromboses ou ischémie aiguë, défaillance cardiaque…