L’AMP vigilance est une vigilance sanitaire réglementée de mise en place récente. Sa création a été demandée par le législateur au travers de la loi n°2004-800 du 6 août 2004 relative à la bioéthique et sa mise en œuvre confiée à l’Agence de la biomédecine. Le décret de juin 2008 1 a complété l’organisation du dispositif et précisé les rôles des différents acteurs.
L’AMP vigilance a pour objet la surveillance des incidents relatifs aux gamètes, aux tissus germinaux et aux embryons utilisés à des fins d’assistance médicale à la procréation ou à des fins de préservation de la fertilité, ainsi que des effets indésirables observés chez les donneurs de gamètes ou chez les personnes qui ont recours à l’assistance médicale à la procréation.
On entend par incident tout accident ou erreur survenant au cours des différentes étapes du processus d’AMP, susceptible d’entraîner un effet indésirable sur la personne ou la perte de gamètes, de tissus germinaux ou d’embryons. À titre d’exemple, des incidents à type de perte partielle ou totale d’embryons liée à un matériel défectueux (ex : panne de congélateur) ou de problèmes d’étiquetage des tubes de liquide folliculaire ont été rapportés.
On entend par effet indésirable toute réaction nocive survenant chez une personne liée ou susceptible d’être liée aux activités d’AMP au cours de ses différentes étapes (stimulation, ponction folliculaire, insémination, transfert embryonnaire). À titre d’exemple, des effets indésirables à type d’hyperstimulations ovariennes sévères, d’hémopéritoines, et d’accidents thromboemboliques ont été rapportés.
Chaque centre autorisé pour les activités d’AMP doit désigner un correspondant local d’AMP vigilance (CLA). Ce dernier a pour missions de recueillir tous les incidents et les effets indésirables, de les déclarer sans délai à l’Agence de la biomédecine, d’informer les autres correspondants locaux d’AMP vigilance si nécessaire et les autres vigilances sanitaires concernées de son établissement, de participer aux investigations, d’aviser l’Agence de la biomédecine des résultats des investigations et en cas de difficultés de fonctionnement du dispositif. Tout autre professionnel qui ne dépend pas d’un centre d’AMP et qui a connaissance de la survenue d’un événement indésirable doit en informer sans délai l’Agence de la biomédecine. En pratique, il est préférable que ce professionnel de santé en informe le centre d’AMP dans lequel le couple a été pris en charge initialement et que le CLA fasse la déclaration de l’événement indésirable.
Fin 2010, le réseau d’AMP vigilance comprend 191 correspondants locaux d’AMP vigilance désignés dans 92% des 208 centres d’AMP.
Les déclarations d’AMP vigilance sont évaluées et expertisées par l’Agence de la biomédecine en lien avec un groupe de travail externe “AMP vigilance” composé d’experts biologistes et gynécologues-obstétriciens spécialisés dans le domaine de l’AMP. L’Agence de la biomédecine peut proposer ou mettre en œuvre des mesures préventives et/ou correctives dans un but de réduction des risques et d’amélioration des pratiques.
En 2010, l’Agence de la biomédecine a mis en place la commission nationale d’AMP vigilance. Elle assure son secrétariat.
Cette vigilance comporte une dimension transversale forte, impliquant souvent d’autres systèmes de vigilance. Il en résulte la nécessité de développer une coordination aussi bien au niveau local que national avec les autres systèmes, notamment la matériovigilance et la pharmacovigilance.
Depuis la mise en place du dispositif en 2007, l’Agence de la biomédecine reçoit les déclarations d’incidents et/ou d’effets indésirables au moyen d’un formulaire standardisé envoyé par fax, mail ou courrier.
Depuis le 23 mars 2010, l’Agence de la biomédecine a déployé une application informatique appelée AMP Vigie, via un portail sécurisé qui permet aux correspondants locaux d’AMP vigilance de déclarer en ligne les incidents et effets indésirables en AMP. Les données du début de l’année 2010 qui avaient été saisies par le pôle Sécurité / Qualité dans une base Access® ont été reprises dans AMP Vigie le 15 décembre 2010.
Bilan des déclarations d’AMP vigilance
Le nombre de déclarations a augmenté de façon importante entre 2007 et 2010, témoignant de la montée en charge du dispositif (cf.fig.AMPV1). Cette augmentation apparente des déclarations témoigne d’une appropriation progressive du dispositif due probablement à une meilleure connaissance du dispositif et à un développement de la culture du signalement chez les professionnels. Elle ne traduit probablement pas une augmentation réelle des déclarations mais plutôt un développement de la notification.
Depuis la mise en place du dispositif, 80% des centres clinico-biologiques et 5% des laboratoires d’insémination artificielle (IA) ont notifié au moins un événement indésirable au système d’AMP vigilance.
Il est précisé que depuis 2010, le mode de comptabilisation des déclarations par année a été modifié. Avant 2010, les déclarations étaient comptabilisées par rapport à la date de survenue de l’événement indésirable et après 2010, les déclarations ont été comptabilisées par rapport à la date de déclaration à l’Agence de la biomédecine.
Figure AMPV1. Evolution du nombre de déclarations d'AMP vigilance entre 2007 et 2010
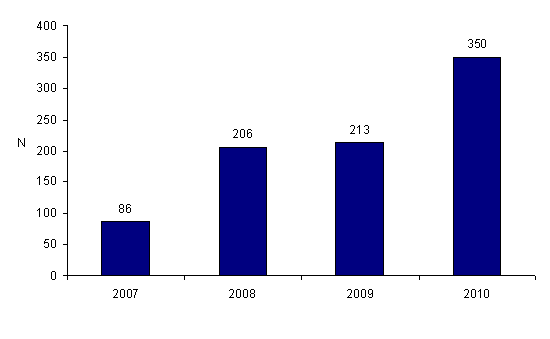
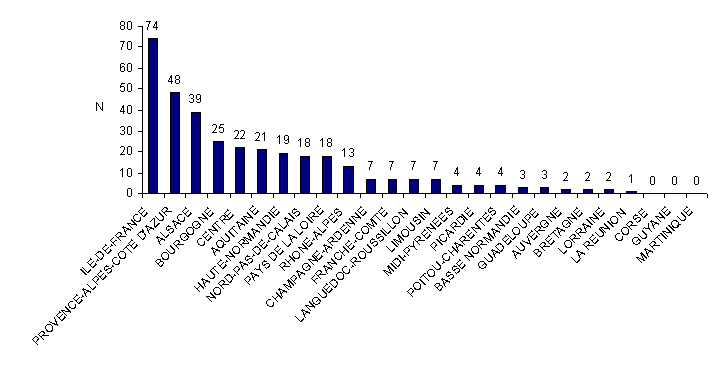
Distribution des déclarations d’AMP vigilance par région
En 2010, 73 centres d’AMP répartis dans 23 régions ont fait au moins une déclaration d’AMP vigilance. Dans 3 régions (Corse, Guyane et Martinique) les centres n’ont fait aucune déclaration. Dans les autres régions, entre 1 et 74 déclarations d'AMP vigilance ont été faites par région.
Figure AMPV2. Nombre de déclarations d'AMP vigilance en fonction des régions (n = 350, 2010)
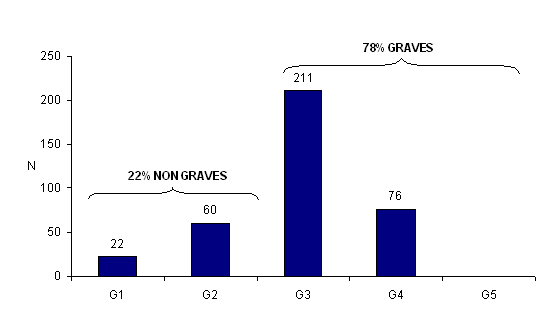
Distribution des incidents et des effets indésirables en fonction de la gravité
En 2010, 287 événements indésirables (77,7%) sont classés comme graves 2 (G3, G4) (fig. AMPV3).
Il existe 5 niveaux de gravité G1 à G5 présentés ci-dessous :
|
G1 |
Diminution de la performance du processus, sans conséquence sur son résultat, et/ou source de contrainte opérationnelle acceptable |
|
G2 |
Dégradation de la performance du processus susceptible ou ayant altéré de façon modérée son résultat et/ou source de contrainte opérationnelle non acceptable |
|
G3 |
Dégradation de la performance du processus ayant altéré de façon importante son résultat. |
|
G4 |
Acte ou procédure sur un patient autre (erreur d’attribution) |
|
G5 |
Décès au cours du processus d’AMP |
Figure AMPV3. Nombre total d'incidents et/ou d'effets indésirables en fonction de la gravité (n = 369 3, 2010)
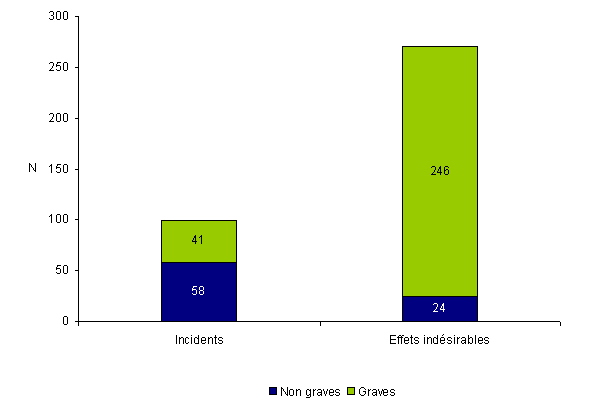
En 2010, les 350 déclarations d’AMP vigilance sont réparties en 99 incidents et 270 effets indésirables parmi lesquels la proportion d’événements graves est de l’ordre de 80% comme les années précédentes (cf. fig.AMPV4). Au total, 67% des centres d’AMP clinico-biologiques (71 sur 107) et 2% des laboratoires d’insémination artificielle (2 sur 101) ont déclaré au moins un événement indésirable.
Figure AMPV4. Nombre d'incidents et d'effets indésirables en fonction de la gravité (n = 369, 2010)
Distribution des incidents et des effets indésirables en fonction de la typologie et de la gravité
Pour l’année 2010, 200 événements indésirables (54,2%) sont relatifs à la stimulation ovarienne4, 76 (20,6%) sont relatifs à un geste clinique lors de l’AMP (insémination, ponction, transfert,..), 40 (10,8%) sont relatifs à la perte de gamètes/embryons, 16 (4,3%) sont relatifs à la structure (locaux, équipements, pratiques), 10 (2,7%) sont relatifs à une erreur d’identification et/ou d'attribution des gamètes ou embryons et 27 (7,3%) sont classés comme « autres ».
Figure AMPV5. Distribution des incidents et/ou des effets indésirables en fonction de la typologie (n = 369, 2010)
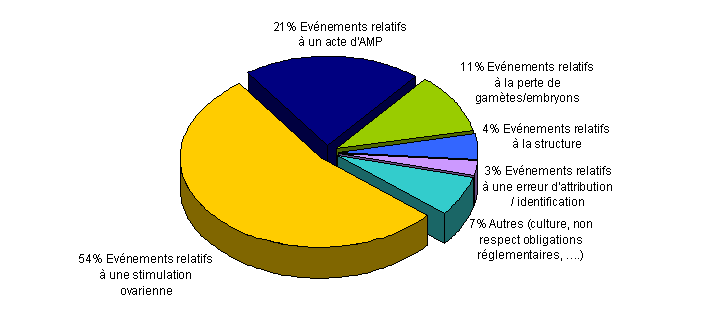
Evénements relatifs à la stimulation ovarienne
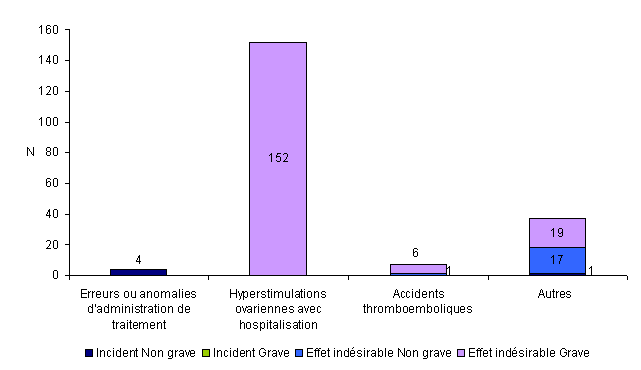
Parmi les 200 événements indésirables associés à la stimulation ovarienne, on dénombre 5 incidents non graves et 195 effets indésirables (177 effets indésirables graves et 18 effets non graves). La plupart de ces événements (152/200 = 76%) concernent un syndrome d'hyperstimulation ovarienne avec hospitalisation, 4 concernent des erreurs d'administration, 7 concernent des accidents thromboemboliques et 37 sont classés comme « autres ».
Les 37 événements « autres » sont répartis en 36 effets indésirables (19 graves et 17 non graves) et 1 incident non grave. Les 36 effets indésirables sont répartis en 5 cas de douleurs pelviennes, 12 cas de torsions d’annexes, 17 cas de syndromes d’hyperstimulation ovarienne sans hospitalisation, 1 cas de réaction allergique, 1 cas de diagnostic de cancer du sein. L’incident non grave est une erreur de transmission des résultats.
Figure AMPV6. Nombre d'incidents et d'effets indésirables relatifs à la stimulation ovarienne en fonction de la gravité (n = 200, 2010)
Evénements relatifs à un geste clinique lors de l’AMP
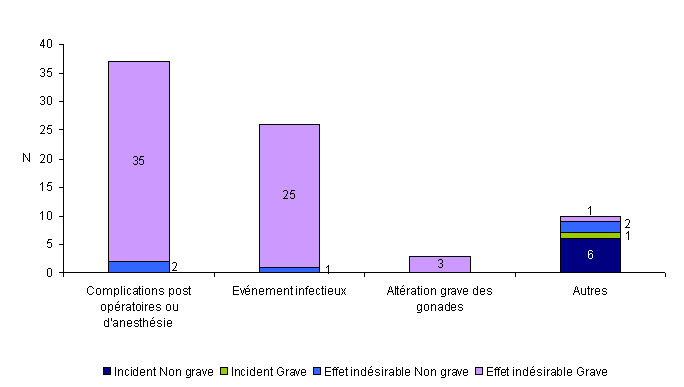
Soixante-seize (20,6%) des événements indésirables rapportés en 2010 sont à rattacher à un geste clinique lors de l’AMP (insémination, ponction folliculaire, transfert embryonnaire, ...). Ces événements sont répartis en 7 incidents (1 incident grave et 6 incidents non graves) et 69 effets indésirables (64 effets indésirables graves et 5 effets indésirables non graves). La plupart de ces événements (37/76 = 49%) concernent des complications post opératoires ou d'anesthésie (ex : hémopéritoine, hématome,…) et 34% des événements infectieux (abcès, pelvipéritonite,…).
Figure AMPV7. Nombre d'incidents et d'effets indésirables relatifs à un geste clinique lors de l'AMP en fonction de la gravité (n = 76, 2010)
Evénements relatifs à une perte de gamètes / embryons
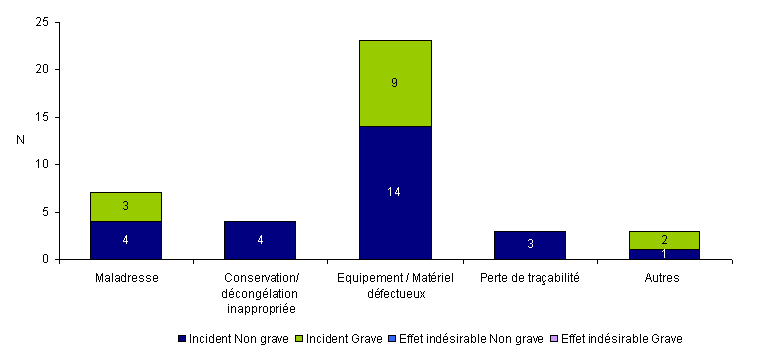
Quarante (10,8%) des événements indésirables rapportés en 2010 concernent des événements relatifs à une perte de gamètes ou d’embryons. Ces événements sont constitués uniquement d’incidents dont 26 incidents non graves et 14 incidents graves. La plupart de ces incidents (23/40 = 58%) sont en rapport avec un équipement ou un matériel défectueux.
Figure AMPV8. Nombre d'incidents et d'effets indésirables relatifs à la perte ou à la destruction accidentelle de gamètes/embryons en fonction de la gravité
(n = 40, 2010)
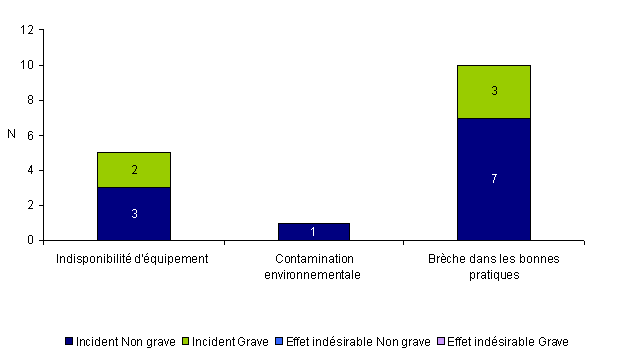
Evénements relatifs à la structure (locaux, équipements, pratiques)
Seize (4,3%) des événements indésirables rapportés en 2010 concernent la structure (locaux, équipements, pratiques). Il s’agissait uniquement d’incidents dont 11 incidents non graves et 5 incidents graves. Le plus souvent (10/16 = 63%), ces incidents concernent une brèche dans les bonnes pratiques.
Figure AMPV9. Nombre d'incidents et d'effets indésirables relatifs à la structure en fonction de la gravité (n = 16, 2010)
Distribution des incidents et des effets indésirables en fonction de l'imputabilité
Le déclarant doit évaluer l’imputabilité de l’événement indésirable par rapport au processus d’AMP selon une échelle d’imputabilité proposée par l’Agence de la biomédecine. L’imputabilité consiste en l’analyse de la relation causale entre la survenue d’un événement indésirable observé et un autre événement survenu en amont susceptible d’en être la cause. Le niveau d’imputabilité peut varier entre celui établi lors de la survenue de l’événement indésirable et celui retenu après investigation du cas. La distribution des déclarations en fonction de l’imputabilité est présentée à la figure AMPV10.
Figure AMPV10. Nombre total d'incidents et/ou d'effets indésirables en fonction de l’imputabilité (n = 369, 2010)
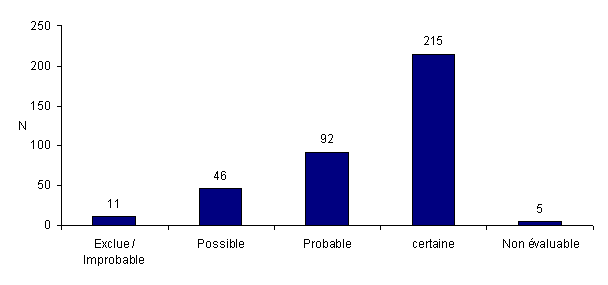
Pour plus d’informations, le rapport annuel d’AMP vigilance 2010 envoyé au ministre du travail, de l’emploi et de la santé est téléchargeable à partir de juillet 2011 sur le site de l’Agence de la biomédecine (http://www.agence-biomedecine.fr/professionnels/amp-vigilance.html)
1 Décret n°2008-588 du 19 juin 2008 transposant en matière de don de gamètes et d’assistance médicale à la procréation la directive 2004/23/CE du Parlement européen et du Conseil du 31 mars 2004
2 Un effet indésirable est considéré comme grave s’il est susceptible d’entraîner la mort ou de mettre la vie en danger, d’entraîner une invalidité ou une incapacité, de provoquer ou de prolonger une hospitalisation ou tout autre état morbide ou susceptible de se reproduire chez un ou plusieurs donneurs ou personnes qui ont recours à l’assistance médicale à la procréation.
Un incident est considéré comme grave s’il est susceptible d’entraîner des effets indésirables graves. Est également considéré comme incident grave tout incident susceptible d’occasionner une erreur d’attribution ou une perte de gamètes, tissus germinaux ou embryons avec perte de chance totale de procréation sur la tentative ou pour le couple.
3 Une même déclaration peut contenir plusieurs incidents ou effets indésirables.
4 En 2009, 115 événements indésirables associés à la stimulation ovarienne ont été rapportés au système d’AMP vigilance.
