En 2015 un peu plus de 464 200 personnes ont bénéficié d’un examen génétique (-3,5% par rapport à 2014).
Un examen de génétique postnatale consiste à analyser les caractéristiques génétiques héritées ou acquises à un stade précoce du développement prénatal.
Cette analyse a pour objet (Article R. 1131-1 du code de la santé publique):
- Soit de poser, de confirmer ou d’infirmer le diagnostic d’une maladie à caractère génétique chez une personne ;
- Soit de rechercher les caractéristiques d’un ou plusieurs gènes susceptibles d’être à l’origine du développement d’une maladie chez une personne ou les membres de sa famille potentiellement concernés ;
- Soit d’adapter la prise en charge médicale d’une personne selon ses caractéristiques génétiques.
Les examens de génétique somatique et les examens réalisés dans le cadre du don (notamment analyses HLA dans le cadre de la greffe) sont en dehors du champ de la loi de bioéthique et donc de ce rapport annuel d’activité.
Différentes techniques permettent d’analyser ces caractéristiques génétiques. Si l’anomalie génétique est visible au niveau du chromosome, les techniques utilisées seront le plus souvent des techniques de cytogénétique (caryotype) y compris de cytogénétique moléculaire (FISH). Si l’anomalie se situe au niveau de la molécule d’ADN, du gène, une technique de génétique moléculaire sera plutôt employée. Cette frontière autrefois franche entre cytogénétique et génétique moléculaire tend à disparaitre avec l’avènement de techniques qui permettent d’appréhender des remaniements chromosomiques au niveau moléculaire (analyse chromosomique par puce à ADN ; techniques de séquençage à haut débit aussi appelées séquençage de nouvelle génération (NGS)).
Ce rapport d’activité de génétique postnatale constitue un outil important notamment dans le cadre de suivi des SROS et du second plan maladies rares. Ce rapport unique en Europe, créé relativement récemment, est en constante évolution pour s’adapter à l’évolution des pratiques.
Matériel et méthodes
Les données de génétique postnatale correspondent à l’activité 2015 des laboratoires. Elles ont été recueillies de manière spécifique en coopération avec Orphanet.
La base de données a été figée le 4 avril 2016. Les modifications apportées après cette date n’ont pas été prises en compte.
Un laboratoire de cytogénétique et un laboratoire de génétique moléculaire n’ont pas transmis leur rapport d’activité avant le gel de la base de données, cependant 99% (227/229) des laboratoires contactés ont rendu leur rapport annuel d’activité. Parmi les 227 laboratoires qui ont rendu leur rapport d’activité, un laboratoire n’a pas eu d’activité au cours de l’année 2015.
Une modification du questionnaire de recueil des données d’activité a été réalisée en 2015, de façon à prendre en compte l’utilisation des techniques de séquençage à haut débit. Cette modification impacte les données d’activité de génétique moléculaire. La comparaison avec les années précédentes doit prendre en compte ce facteur.
Laboratoires de génétique postnatale
Parmi les 226 laboratoires ayant déclaré une activité à l’Agence de la biomédecine, 70 ont au moins une activité de cytogénétique y compris de cytogénétique moléculaire et 183 au moins une activité de génétique moléculaire. Vingt-sept laboratoires réalisent les deux activités. Un tiers des laboratoires autorisés pour la génétique moléculaire le sont uniquement pour une activité limitée (34,4%). Dans cette dernière situation, l’activité peut être limitée à un ou plusieurs examens de réalisation et d’interprétation généralement plus simples et qui nécessite une expertise complémentaire (exemple en hématologie, pharmacologie) (tableaux POSTNATAL1 et POSTNATAL2).
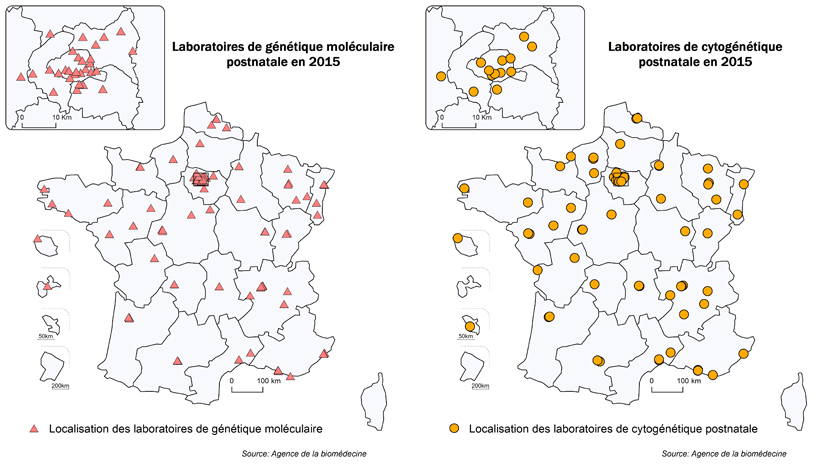
Les deux cartes de la figure POSTNATAL1 montrent la répartition géographique des laboratoires sur le territoire français. Toutes les régions (hormis la Corse, la Guadeloupe, la Guyane et Mayotte (non représentée)) possèdent au moins un laboratoire de cytogénétique constitutionnelle. La répartition de cette activité sur le territoire donne une indication sur l’organisation et l’offre de soins nationale mais en aucun cas ne permet d'appréhender l'offre de soins de proximité. Souvent les laboratoires travaillent en réseau. En effet, les prélèvements voyageant, certains d’entre eux proposent un diagnostic d’expertise pour l'ensemble de la France. Les laboratoires ayant une activité non limitée ne peuvent pas et ne doivent pas développer un catalogue complet de diagnostics car ils doivent maintenir l’expertise nécessaire à l’analyse et l’interprétation des résultats. Seule une cartographie des consultations de génétique pourrait montrer l'accès aux soins au niveau régional.
Tableau POSTNATAL1. Laboratoires ayant une activité de génétique postnatale d'après les déclarations faites dans les rapports d'activité
|
2011 |
2012 |
2013 |
2014 |
2015 |
Nombre de laboratoires avec une activité de cytogénétique |
76 |
73 |
70 |
71 |
70 |
Nombre de laboratoires avec une activité de génétique moléculaire |
180 |
180 |
184 |
180 |
183 |
. avec une activité à autorisation non limitée |
104 |
110 |
121 |
111 |
120 |
. avec une activité à autorisation limitée |
76 |
70 |
63 |
69 |
63 |
Nombre total de laboratoires* |
235 |
232 |
231 |
225 |
226 |
* Certains laboratoires proposent une activité de génétique moléculaire et de cytogénétique (soit 27 en 2015)
Tableau POSTNATAL2. Activités pratiquées par les laboratoires de génétique moléculaire ayant une autorisation limitée
|
Nombre de laboratoires |
||||
2011 |
2012 |
2013 |
2014 |
2015 |
|
Facteurs II et V |
36 |
35 |
35 |
37 |
33 |
Hématologie |
20 |
18 |
16 |
18 |
18 |
Hémochromatose |
14 |
16 |
13 |
11 |
10 |
Analyses de biologie moléculaire appliquée à la cytogénétique |
3 |
3 |
2 |
3 |
3 |
Pharmacogénétique |
12 |
8 |
11 |
12 |
12 |
Typages HLA |
6 |
8 |
9 |
12 |
11 |
Autre |
29 |
24 |
18 |
14 |
12 |
Répartition des laboratoires de cytogénétique et de génétique moléculaire postnatale ayant déclaré une activité de génétique postnatale sur le territoire français
Figure POSTNATAL1. Répartition géographique des laboratoires de cytogénétique et de génétique moléculaire postnatale ayant déclaré une activité en 2015
Résumé de l'activité de génétique postnatale
Tableau POSTNATAL3. Résumé de l'activité de génétique postnatale
|
2011 |
2012 |
2013 |
2014 |
2015 |
Cytogénétique |
. |
. |
. |
. |
. |
Nombre d'individus testés |
74 334 |
72 850 |
68 370 |
68 568 |
67 744 |
Nombre total d'analyses |
85 015 |
82 798 |
77 168 |
78 229 |
76 086 |
. par caryotype |
71 553 |
69 405 |
66 049 |
66 014 |
64 382 |
. par FISH |
13 462 |
13 393 |
11 119 |
12 215 |
11 704 |
Génétique moléculaire (y compris pharmacogénétique) |
. |
. |
. |
. |
. |
Nombre d'individus testés |
329 638 |
323 158 |
357 841 |
397 798 |
379 960 |
Nombre de maladies* différentes recherchées |
1 041 |
1 194 |
1 275 |
1 355 |
1 518 |
Nombre d'examens réalisés** |
388 159 |
415 627 |
430 152 |
481 532 |
399 008 |
Puces |
. |
. |
. |
. |
. |
Nombre de dossiers rendus |
10 104 |
12 133 |
14 406 |
14 711 |
16 543 |
* Maladies répertoriées dans la classification Orphanet
** Le nombre d’examens 2015 n’est pas comparable aux années précédentes : le questionnaire de recueil de données a été modifié en 2015 de façon à prendre en compte l’utilisation des techniques de séquençage à haut débit.
Activité de cytogénétique
L’activité de cytogénétique postnatale a diminué depuis 2010. En 2015 environ 67 750 individus ont bénéficié d’une FISH ou d’un caryotype (tableau POSTNATAL3).
Avec 64 382 examens en 2015, le caryotype reste très pratiqué en génétique postnatale (tableau POSTNATAL3), néanmoins le nombre d’examens est en baisse constante depuis 2011 (tableau POSTNATAL5). On observe une diminution de 2,5% par rapport à 2014 et de 10% si l’on compare à l’année 2011. La diminution du nombre de caryotypes concerne principalement l’indication « Déficience intellectuelle, malformation, anomalies du développement ». L’explication est probablement l’utilisation pour cette indication d’autres outils de génétique : les puces (cf. chapitre puce) et les panels par NGS (cf. chapitre génétique moléculaire).
Les analyses d’hybridations in situ (FISH) sont souvent réalisées en complément d’un caryotype. En revanche, les FISH réalisées dans le cadre de validation de résultats de puces ne sont pas comptabilisées ici.
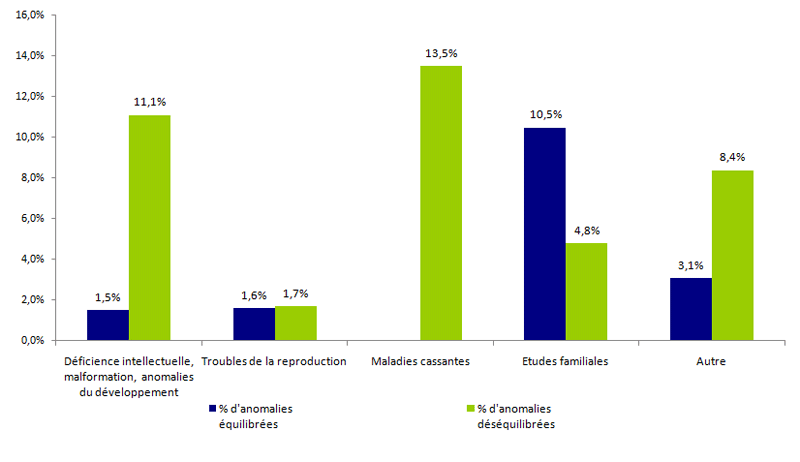
Les grands groupes d’indications sont présentés dans le tableau POSTNATAL4. Les examens de cytogénétique postnatale sont plus souvent prescrits pour expliquer un trouble de la reproduction, mais le taux d’anomalies diagnostiquées reste faible pour cette indication vis-à-vis des autres (figure POSTNATAL2).
En plus de ces grands groupes d’indications définis en collaboration avec les sociétés savantes de cytogénétique, l’Agence de la biomédecine recueille spécifiquement le nombre de cas de trisomies 21 diagnostiquées en génétique postnatale lorsque qu’il n’y a pas eu de diagnostic en prénatal (tableau POSTNATAL6, tableau POSTNATAL7, tableau POSTNATAL8). L’absence de DPN (diagnostic prénatal) correspond à plusieurs situations : soit des femmes ayant eu un dépistage positif et ne souhaitant pas avoir de diagnostic, soit des femmes ayant eu un dépistage négatif (faux négatif), soit des femmes n’ayant eu ni dépistage ni diagnostic au cours de leur grossesse. Cette donnée fait partie du dispositif global de suivi du dépistage de la trisomie 21 et fait l’objet d’une analyse dans ce contexte (cf. rapport annuel d’activité de diagnostic prénatal). En 2015, 481 diagnostics postnatals de trisomies 21 ont été posés par les laboratoires de cytogénétique. Soit une diminution par rapport à 2014 (n=563). Parmi ces naissances, le parcours prénatal des femmes est inconnu pour 38,5% d’entre elles, ¼ des femmes n’avaient pas réalisé de dépistage et 37% avaient choisi d’avoir un dépistage.
Parmi les femmes ayant un dépistage mais n’ayant pas réalisé de diagnostic, 60% n’étaient pas dans la zone à risque et 34,3% d’entre elles l’étaient.
Une attention particulière doit être portée sur le nombre important de parcours prénatal inconnus.
Tableau POSTNATAL4. Activité 2015 de cytogénétique postnatale
Indications |
Techniques |
Nombre |
Nombre |
Nombre |
Nombre |
Déficience intellectuelle, malformation, anomalies du développement |
Caryotype |
14220 |
12436 |
208 |
1576 |
FISH |
5370 |
4158 |
284 |
928 |
|
Troubles de la reproduction |
Caryotype |
40626 |
39252 |
670 |
704 |
FISH |
3060 |
2125 |
470 |
465 |
|
Maladies cassantes |
Caryotype |
281 |
243 |
0 |
38 |
FISH |
6 |
4 |
0 |
2 |
|
Etudes familiales |
Caryotype |
6004 |
5083 |
630 |
291 |
FISH |
2638 |
1759 |
378 |
501 |
|
Autre |
Caryotype |
3251 |
2878 |
100 |
273 |
FISH |
630 |
351 |
103 |
176 |
|
Total |
Caryotype |
64382 |
59892 |
1608 |
2882 |
FISH |
11704 |
8397 |
1235 |
2072 |
Tableau POSTNATAL5. Evolution de l'activité de cytogénétique postnatale selon l'indication du prélèvement
|
Nombre d'examens |
|||||
Indications |
Techniques |
2011 |
2012 |
2013 |
2014 |
2015 |
Déficience intellectuelle, malformation, anomalies du développement |
Caryotype |
18730 |
18643 |
16415 |
16096 |
14220 |
FISH |
7735 |
7174 |
5652 |
5809 |
5370 |
|
Troubles de la reproduction |
Caryotype |
41712 |
40361 |
39652 |
40422 |
40626 |
FISH |
2125 |
2244 |
2549 |
2950 |
3060 |
|
Maladies cassantes |
Caryotype |
281 |
283 |
280 |
318 |
281 |
FISH |
23 |
19 |
6 |
3 |
6 |
|
Etudes familiales |
Caryotype |
8119 |
7716 |
7044 |
6413 |
6004 |
FISH |
3165 |
3473 |
2544 |
2903 |
2638 |
|
Autre |
Caryotype |
2711 |
2402 |
2658 |
2765 |
3251 |
FISH |
414 |
483 |
368 |
550 |
630 |
|
Total |
Caryotype |
71553 |
69405 |
66049 |
66014 |
64382 |
FISH |
13462 |
13393 |
11119 |
12215 |
11704 |
|
Figure POSTNATAL2. Fréquence des anomalies identifiées par caryotype en 2015 selon l'indication et le type d'anomalie
Suivi du dispositif de dépistage prénatal de la trisomie 21
Tableau POSTNATAL6. Suivi du nombre de trisomies 21 diagnostiquées par caryotype postnatal*
|
2011 |
2012 |
2013 |
2014 |
2015 |
Nombre de cas de trisomies 21 diagnostiquées par caryotype postnatal chez des enfants nés vivants en France |
535 |
488 |
500 |
563 |
481 |
* Diagnostic postnatal de trisomies 21 d’enfants nés vivants en France sans diagnostic prénatal
Tableau POSTNATAL7. Parcours prénatal des trisomies 21 diagnostiquées par caryotype postnatal*
Parcours prénatal |
Enfants nés vivants diagnostiqué T21 par caryotype postnatal |
Dépistage de la trisomie 21 par les marqueurs sériques |
178 |
Sans dépistage de la trisomie 21 par les marqueurs sériques |
118 |
Parcours prénatal inconnu |
185 |
Total |
481 |
* Diagnostic postnatal de trisomies 21 d’enfants nés vivants en France sans diagnostic prénatal
Tableau POSTNATAL8. Résultat du dépistage prénatal des trisomies 21 diagnostiquées par caryotype postnatal*
Résultat du dépistage prénatal |
Test combiné du 1er trimestre |
Test séquentiel intégré |
Test des marqueurs sériques du 2e trimestre |
Type de dépistage réalisé non connu |
Total |
|||||
N |
% |
N |
% |
N |
% |
N |
% |
N |
% |
|
Risque >= 1/250 |
45 |
37,2 |
1 |
25,0 |
3 |
17,6 |
12 |
33,3 |
61 |
34,3 |
Risque < 1/250 |
75 |
62,0 |
3 |
75,0 |
14 |
82,4 |
15 |
41,7 |
107 |
60,1 |
Résultat inconnu |
1 |
0,8 |
0 |
0,0 |
0 |
0,0 |
9 |
25,0 |
10 |
5,6 |
Total |
121 |
100,0 |
4 |
100,0 |
17 |
100,0 |
36 |
100,0 |
178 |
100,0 |
*Diagnostic postnatal de trisomies 21 d’enfants nés vivants en France sans diagnostic prénatal
Activité de recherche d'une anomalie chromosomique par analyse moléculaire
Les recherches d’anomalies chromosomiques par analyse moléculaire sont des techniques aussi bien utilisées par les laboratoires de cytogénétique que par les laboratoires de génétique moléculaire.
L’organisation des différents laboratoires ou plateformes est très variable, ce qui rend compliqué le recueil de l’activité dans ce domaine puisqu’un même examen peut être pris en compte par plusieurs laboratoires. L’information qui a semblé la plus pertinente étant le nombre de patients ayant accès à un diagnostic par cette technologie, le choix a été fait d’analyser le nombre de dossiers rendus et pas le nombre d’analyses réalisées. Cette donnée correspond à un résultat diagnostique rendu au prescripteur après analyse des puces et validation de l’anomalie génétique identifiée par une autre technique (en général FISH ou qPCR (quantitative Polymerase Chain Reaction)).
Analyse par puces
Le rapport d’activité recense près de 16 500 dossiers d’analyses par puces rendus au prescripteur en 2015. L’utilisation des puces est en constante augmentation : + 12,5 % par rapport à l’année 2014, + 63,7% si l’on compare l’activité avec celle de l’année 2011 (tableau POSTNATAL10, figure POSTNATAL3).
La quasi-totalité des examens sont réalisés pour des analyses pangénomiques et non pour des analyses ciblées (15 995 dossiers rendus versus 548). La principale indication demeure« Déficience intellectuelle ou trouble des apprentissages dans un cadre syndromique ».
L’indication « Caractérisation d'une anomalie découverte au caryotype ou par une autre technique (MLPA, FISH,...) » a un résultat positif dans 61,8% des cas.
Figure POSTNATAL3. Evolution du nombre de dossiers d'analyses par puces rendus
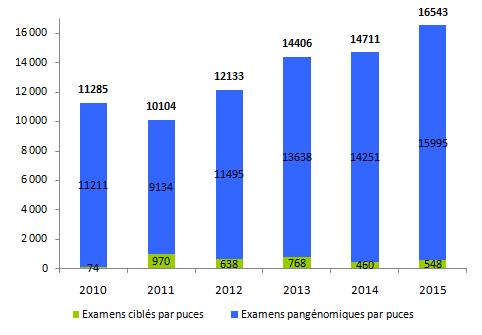
Tableau POSTNATAL9. Evolution des examens ciblés par puces
|
Analyses ciblées par puces |
||||
2011 |
2012 |
2013 |
2014 |
2015 |
|
Nombre de laboratoires |
12 |
12 |
11 |
11 |
11 |
Nombre de dossiers rendus |
970 |
638 |
768 |
460 |
548 |
Nombre de dossiers positifs rendus* |
375 |
234 |
145 |
72 |
105 |
% de dossiers positifs rendus |
38,7% |
36,7% |
18,9% |
15,7% |
19,2% |
* Un dossier est considéré comme positif lorsqu’un résultat d’anomalie est rendu
Tableau POSTNATAL10. Evolution de l'activité des examens pangénomiques par puces
|
2011 |
2012 |
2013 |
2014 |
2015 |
Nombre de laboratoires |
37 |
38 |
44 |
44 |
45 |
Nombre de dossiers rendus |
9 134 |
11 495 |
13 638 |
14 251 |
15 995 |
Nombre de dossiers positifs rendus* |
1 941 |
2 403 |
3 003 |
3 063 |
3 460 |
% de dossiers positifs rendus |
21,3% |
20,9% |
22,0% |
21,5% |
21,6% |
* Un dossier est considéré comme positif lorsqu’un résultat d’anomalie est rendu
Tableau POSTNATAL11. Examens pangénomiques par puces réalisés en 2015
Indications |
Nombre de |
Nombre de |
% de dossiers |
Déficience intellectuelle ou trouble des apprentissages dans un cadre syndromique |
5422 |
1274 |
23,5% |
Malformations sans retard psychomoteur |
1879 |
310 |
16,5% |
Déficience intellectuelle ou trouble des apprentissages isolés |
2790 |
551 |
19,7% |
Troubles envahissants du développement (TED)/ Autisme |
2133 |
288 |
13,5% |
Caractérisation d'une anomalie découverte au caryotype ou par une autre technique (MLPA, FISH,...) |
327 |
202 |
61,8% |
Fœtopathologie |
704 |
115 |
16,3% |
Autres |
2740 |
720 |
26,3% |
Total |
15995 |
3460 |
21,6% |
Tableau POSTNATAL12. Evolution du nombre d'examens pangénomiques par puces selon l'indication
|
Nombre de dossiers rendus |
||||
Indications |
2011 |
2012 |
2013 |
2014 |
2015 |
Déficience intellectuelle ou trouble des apprentissages dans un cadre syndromique |
4 555 |
5 339 |
5 474 |
5 431 |
5 422 |
Malformations sans retard psychomoteur |
559 |
1 117 |
1 453 |
1 736 |
1 879 |
Déficience intellectuelle ou trouble des apprentissages isolés |
1 511 |
2 208 |
2 476 |
2 301 |
2 790 |
Troubles envahissants du développement (TED)/ Autisme |
595 |
1 108 |
1 446 |
1 869 |
2 133 |
Caractérisation d'une anomalie découverte au caryotype ou par une autre technique (MLPA, FISH,...) |
661 |
346 |
481 |
346 |
327 |
Fœtopathologie |
548 |
632 |
742 |
684 |
704 |
Autres |
705 |
745 |
1 566 |
1 884 |
2 740 |
Total |
9 134 |
11495 |
13638 |
14251 |
15995 |
Autres recherches d'anomalie chromosomique par analyse moléculaire (MLPA, QF-PCR, QMPSF...)
D’autres techniques de génétique moléculaire permettent la recherche d’anomalies chromosomiques, notamment : la MLPA (Multiplex ligation-dependent probe amplification), QF-PCR (Quantitative Fluorescence -polymerasechainreaction) et la QMPSF (Quantitative Multiplex PCR of Short Fragments). Une part de ces examens est réalisée dans le contexte de validation d’un autre examen, notamment d’une puce. Pour les autres situations, elles permettent le plus souvent de poser le diagnostic de maladies qui sont décrites dans la partie relative à la génétique moléculaire. Le nombre de ce type d’examens reste autour de 15 000 depuis plusieurs années (tableau POSTNATAL13).
Tableau POSTNATAL13. Evolution des autres recherches d’anomalies chromosomiques par analyse moléculaire (MLPA, QF-PCR, QMPSF …)
|
2011 |
2012 |
2013 |
2014 |
2015 |
Autres recherches d'anomalies chromosomiques par analyse moléculaire (MLPA, QF-PCR,QMPSF...) |
15 553 |
16 954 |
14 934 |
15 108 |
14 160 |
Activité de génétique moléculaire
En 2015, près de 399 000 examens de génétique moléculaire ont été réalisés en France (tableau POSTNATAL3). Ils incluaient près de 19 900 examens de pharmacogénétique (5%) (tableau POSTANATAL20). Au final un peu moins de 380 000 personnes ont bénéficié d’un examen de génétique (plusieurs examens peuvent être réalisés pour une même personne).
Nous avons décidé de baser l’identification des maladies sur la classification de l’encyclopédie Orphanet.
Le numéro Orpha est un identifiant unique, stable dans le temps, associé à chaque entité de la classification Orphanet des maladies rares. Ces entités peuvent être des groupes de maladies, des maladies ou des sous-types de maladies. Les numéros Orpha sont destinés, entre autres, à être inclus dans les systèmes d'information en santé afin de permettre l'identification des patients ayant une maladie rare, qu'elle soit génétique ou pas.
Le numéro Orpha désigne des entités cliniques qui peuvent être associés à un ou plusieurs gènes. Ainsi peuvent être comptabilisées comme deux pathologies distinctes deux formes d’une même maladie enregistrées sous deux numéros ORPHA différents.
Chaque numéro Orpha peut correspondre à un ou plusieurs numéros OMIM fréquemment utilisés par les laboratoires.
La génétique moléculaire est en train de vivre une révolution technologique avec l’utilisation des séquenceurs de nouvelles générations (NGS pour NextGenerationSequencing).
En pratique, pour de très nombreuses maladies pouvant impliquer plusieurs gènes ou pour les pathologies qui partageaient une « porte d’entrée » clinique identique, les laboratoires testaient les gènes les uns après les autres avant l’arrivée de cette technologie.
Avec la technologie NGS les laboratoires ont pu développer des panels. Un panel est un ensemble de gènes testés pour une indication. Ainsi, lorsqu’un prélèvement nécessite plusieurs examens différents afin de poser un diagnostic il devient possible de les réaliser en une seule analyse.
L’Agence de la biomédecine a du profondément remanier le rapport annuel d’activité pour appréhender cette évolution des pratiques. En pratique, pour un individu, avant le NGS, le nombre d’examens comptabilisés correspondait à la somme des gènes testés. Avec les panels, le nombre d’examens comptabilisés est égal à un quel que soit le nombre de gènes inclus dans le panel.
En 2015, si une minorité seulement des examens a été réalisée sous forme de panel, il n’est cependant pas possible de comparer l’activité recueillie cette année à celle des années précédentes.
Génétique des maladies
En 2015, 361 183 personnes ont eu un examen de génétique moléculaire, qu’il s’agisse de cas index (personne symptomatique chez qui on fait le diagnostic) ou d’apparentés. Les examens de pharmacogénétique sont présentés dans le chapitre suivant. Les laboratoires français ont réalisé des examens diagnostiques pour 1490 maladies différentes (selon la classification Orphanet)(tableau POSTNATAL13).
Deux indications, « hémochromatose type1» et « thrombophilie non rare » représentent à elles seules près de 35% des examens réalisés en 2015 (tableau POSTNATAL15). Ces examens sont respectivement proposés par 69 et 43 laboratoires. Il s’agit des 2 seuls examens de génétique moléculaire répertoriés dans la nomenclature des actes de biologie médicale. Si en volume, ces deux tests sont importants, leur réalisation est peu couteuse et peu chronophage par rapport à l’analyse de gènes complexes.
La liste des 50 examens les plus réalisés en France (tableau POSTNATAL16) montre la présence de plusieurs maladies pour lesquelles les gènes impliqués sont des gènes de susceptibilité. Une réflexion globale sur l’intérêt de tels examens devra être menée. A titre d’exemple plus de 72600 (18,8%) examens ont porté sur des gènes du HLA en 2015 (hors indication de greffe). Ce chiffre est en constante augmentation.
Il est important de rappeler ici l’arrêté du 27 mai 2013 définissant les règles de bonnes pratiques applicables à l’examen des caractéristiques génétiques d’une personne à des fins médicales qui précise que « Les examens de génétique ne doivent être prescrits que lorsqu’ils ont une utilité clinique et qu’ils sont souhaités par la personne. Le seul fait qu’un examen soit disponible et réalisable ne justifie ni de sa prescription ni de sa réalisation » et que « de nombreux variants génétiques (polymorphismes) sont actuellement identifiés comme ne contribuant à modifier que faiblement un risque de maladie. Le risque de développer la maladie est bien inférieur à celui de la prédisposition. L’anomalie génétique n’est ni nécessaire ni suffisante pour développer la maladie ».
Les laboratoires français ont développé entre 1 et plus de 100 diagnostics de maladies différentes (162), mais 26,7 % d’entre eux ne proposent qu’un ou deux tests (tableau POSTNATAL19).
Les maladies génétiques sont très majoritairement rares, voire très rares. Développer des examens diagnostiques pour ces dernières peut se révéler très complexe. Ainsi, les laboratoires se sont généralement spécialisés, 90 laboratoires sont seuls à proposer le diagnostic d’une maladie en France. Au final, 955 maladies (64 %) ne sont diagnostiquées que dans un seul laboratoire (tableau POSTNATAL17).
Alors qu’en 2013 seuls 36 laboratoires avaient réalisé des examens en utilisant des appareils permettant des analyses NGS (nextgenerationsequencing), ils ont été 80 à le faire en 2015. Cette augmentation montre la montée en puissance de cette technologie. En 2015, environ 36 000 examens de NGS ont été rendus aux prescripteurs soit 9,4% de l’ensemble des examens de génétique moléculaire (hors pharmacogénétique) (vs.16 979 en 2014). Cette augmentation du nombre d’examens par NGS est probablement aussi à mettre en regard de la diminution du nombre de caryotypes (cf. chapitre cytogénétique). Cette évolution des pratiques nécessite que l’on s’assure du maintien de l’exercice en réseau des laboratoires qui individuellement ne pourront développer l’expertise nécessaire à l’interprétation des résultats obtenus sur l’ensemble d’un génome.
Une analyse de niveau 1 consiste en la recherche des mutations les plus fréquentes dont le lien de causalité avec la maladie étudiée est clairement établi. La technique utilisée est généralement simple et repose souvent sur des dispositifs spécifiquement développés pour une recherche ciblée. Pour cette raison, le résultat d’une analyse de niveau 1 est le plus souvent binaire et toutes les mutations ne sont généralement pas étudiées.
Une analyse de niveau 2 consiste en l’analyse exhaustive du gène, la technique peut être simple ou complexe. Toute technique de balayage pour rechercher des mutations inconnues entre dans ce cadre. Pour ce faire, le laboratoire devra assurer notamment la prise en charge d’échantillons d’autres laboratoires lorsque les analyses de niveau 1 n’ont pas permis de mettre en évidence de mutation et si le contexte clinique le justifie. Il devra également assurer la veille technologique et scientifique, la participation à l’organisation du contrôle de qualité, le lien avec un centre de référence de la maladie s’il existe. Le laboratoire réalisant une analyse de niveau 1 est en relation avec un laboratoire de niveau 2 pour cette même analyse. Il est souhaitable que ce dernier laboratoire soit celui qui organise le contrôle de qualité (tableau POSTNATAL15).
La figure POSTNATAL4 montre la répartition des indications par nombre d’examens pratiqués et illustre la rareté de la majorité des maladies génétiques. En effet, près d’un quart des maladies (24,3%) ne sont recherchées au maximum que 10 fois dans l’année et un autre quart (26,9%) entre 10 et 50 fois.
Le nombre d’examens est plus élevé que le nombre d’individus testés car pour une même maladie l’analyse de plusieurs gènes en parallèle ou successivement peut être nécessaire pour poser un diagnostic.
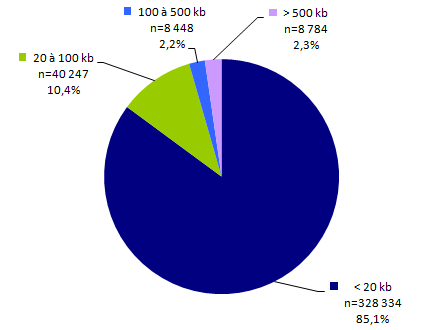
La figure POSTNATAL5 décrit la répartition des examens en fonction de la quantité d’acide nucléique analysée. L’intérêt de cette donnée consiste principalement au suivi de la taille des panels. C’est par ailleurs l’unité de mesure choisie pour les examens réalisés par NGS dans le RIHN (Référentiel des actes Innovants Hors Nomenclature). On observe que pour le moment les panels de grande taille sont minoritaires : 2,2% ont une taille comprise entre 100 et 500 kb (kilobase) et 2,3% une taille supérieure à 500kb.
Tableau POSTNATAL14. Activité de génétique moléculaire postnatale (hors pharmacogénétique)
|
2011 |
2012 |
2013 |
2014 |
2015** |
Nombre de maladies différentes recherchées* |
1 021 |
1 174 |
1 252 |
1 333 |
1 490 |
Nombre d'examens rendus au prescripteur |
372 422 |
395 202 |
404 849 |
461 936 |
385 813 |
- dont nombre d'examens de cas index |
182 754 |
197 798 |
255 062 |
270 286 |
205 958 |
- dont nombre d'examens d'apparentés |
30 370 |
36 583 |
36 917 |
38 390 |
42 459 |
Nombre d'examens de cas index positifs rendus au prescripteur |
27 559 |
30 521 |
38 638 |
35 906 |
39 974 |
* Maladies répertoriées dans la classification ORPHANET
** Le nombre d’examens 2015 n’est pas comparable aux années précédentes : le questionnaire de recueil de données a été modifié en 2015 de façon à prendre en compte l’utilisation des techniques de séquençage à haut débit.
Tableau POSTNATAL15. Nombre d'examens et de laboratoires pour une maladie étudiée par au moins dix laboratoires par génétique moléculaire postnatale en 2015
Indication |
Nombre |
Nombre de |
Nombre de |
Nombre de |
Nombre de |
|
ORPHA64738 |
Thrombophilie non rare |
92 561 |
69 |
0 |
69 |
0 |
ORPHA139498 |
Hémochromatose type 1 |
41 794 |
53 |
3 |
43 |
12 |
ORPHA586 |
Mucoviscidose |
10 490 |
32 |
7 |
19 |
13 |
ORPHA908 |
Syndrome de l'X fragile |
11 705 |
30 |
1 |
20 |
10 |
ORPHA1646 |
Délétion partielle du chromosome Y |
3 787 |
28 |
4 |
24 |
4 |
ORPHA48 |
Absence congénitale bilatérale des canaux déférents |
4 164 |
21 |
3 |
9 |
12 |
ORPHA273 |
Dystrophie myotonique de type 1 |
2 230 |
19 |
0 |
11 |
8 |
ORPHA825 |
Spondylarthrite ankylosante |
52 449 |
19 |
1 |
17 |
2 |
ORPHA145 |
Syndrome héréditaire de prédisposition au cancer du sein et de l'ovaire |
20 774 |
16 |
9 |
0 |
16 |
ORPHA144 |
Syndrome de Lynch |
3 480 |
16 |
7 |
1 |
15 |
ORPHA555 |
Maladie cœliaque |
2 015 |
14 |
1 |
11 |
3 |
ORPHA243377 |
Diabète de type 1 |
2 222 |
14 |
1 |
10 |
4 |
ORPHA2073 |
Narcolepsie-cataplexie |
2 446 |
13 |
1 |
11 |
2 |
ORPHA117 |
Maladie de Behçet |
7 011 |
13 |
1 |
11 |
2 |
ORPHA676 |
Pancréatite chronique héréditaire |
2 555 |
13 |
3 |
5 |
8 |
ORPHA619 |
Insuffisance ovarienne précoce |
5 061 |
13 |
2 |
6 |
8 |
ORPHA739 |
Syndrome de Prader-Willi (Syndrome de Willi-Prader) |
684 |
12 |
1 |
9 |
3 |
ORPHA399 |
Maladie de Huntington |
929 |
12 |
0 |
7 |
5 |
ORPHA70 |
Amyotrophie spinale proximale (SMA) |
1 502 |
11 |
0 |
7 |
4 |
ORPHA733 |
Polypose adénomateuse familiale (Polypose rectocolique familiale) |
1 591 |
11 |
7 |
1 |
10 |
ORPHA72 |
Syndrome d'Angelman |
391 |
11 |
3 |
9 |
2 |
ORPHA848 |
Bêta-thalassémie (Thalassémie bêta) |
589 |
10 |
0 |
3 |
7 |
ORPHA550 |
MELAS |
810 |
10 |
3 |
5 |
5 |
ORPHA179 |
Choriorétinopathie type birdshot |
1 512 |
10 |
1 |
8 |
2 |
ORPHA324 |
Maladie de Fabry |
443 |
10 |
1 |
1 |
9 |
ORPHA778 |
Syndrome de Rett |
874 |
10 |
1 |
2 |
8 |
ORPHA90636 |
Surdité neurosensorielle non syndromique autosomique récessive type DFNB |
1 460 |
10 |
2 |
2 |
8 |
* Analyse de niveau 1 : Recherche des mutations les plus fréquentes dont la causalité pour la maladie étudiée est clairement démontrée. La technique utilisée est généralement simple et souvent basée sur des dispositifs spécifiquement établis pour une recherche ciblée.
Analyse de niveau 2:L’analyse du gène est exhaustive, la technique peut être simple ou complexe. Toute technique de balayage pour rechercher des mutations inconnues rentre dans ce cadre à l’exception des examens réalisés par NGS.
Tableau POSTNATAL16. Classement des 50 indications faisant l'objet du plus grand nombre d'examens en 2015
Le tableau complet décrivant le nombre d’examens par indication est disponible au format Excel sur le site de l’Agence de la biomédecine
ORPHA |
INDICATION |
2015 |
ORPHA64738 |
Thrombophilie non rare |
92561 |
ORPHA825 |
Spondylarthrite ankylosante |
52449 |
ORPHA139498 |
Hémochromatose type 1 |
41794 |
ORPHA145 |
Syndrome héréditaire de prédisposition au cancer du sein et de l'ovaire |
20774 |
ORPHA325 |
Déficit congénital en facteur II |
15147 |
ORPHA908 |
Syndrome de l'X fragile |
11705 |
ORPHA586 |
Mucoviscidose |
10490 |
ORPHA117 |
Maladie de Behçet |
7011 |
ORPHA619 |
Insuffisance ovarienne primaire |
5061 |
ORPHA93256 |
Syndrome tremblement-ataxie lié à une prémutation de l'X fragile |
4295 |
ORPHA48 |
Absence congénitale bilatérale des canaux déférents |
4164 |
ORPHA1646 |
Délétion partielle du chromosome Y |
3787 |
ORPHA144 |
Cancer du côlon héréditaire non polyposique |
3480 |
ORPHA284130 |
Polyarthrite rhumatoïde |
3041 |
ORPHA155 |
Cardiomyopathie hypertrophique familiale isolée |
3033 |
ORPHA29072 |
Phéochromocytome-paragangliome héréditaire |
2577 |
ORPHA676 |
Pancréatite chronique héréditaire |
2555 |
ORPHA2073 |
Narcolepsie-cataplexie |
2446 |
ORPHA273 |
Dystrophie myotonique de type 1 |
2230 |
ORPHA243377 |
Diabète sucré de type 1 |
2222 |
ORPHA555 |
Maladie coeliaque |
2015 |
ORPHA342 |
Fièvre méditerranéenne familiale |
1738 |
ORPHA395 |
Homocystinurie par déficit en méthylène tétrahydrofolate réductase |
1670 |
ORPHA733 |
Polypose adénomateuse familiale |
1591 |
ORPHA93111 |
Syndrome kystes rénaux-diabète |
1591 |
ORPHA179 |
Choriorétinopathie type Birdshot |
1512 |
ORPHA70 |
Amyotrophie spinale proximale |
1502 |
ORPHA90636 |
Surdité neurosensorielle non syndromique autosomique récessive type DFNB |
1460 |
ORPHA552 |
Syndrome MODY |
1406 |
ORPHA220460 |
Polypose adénomateuse familiale atténuée |
1252 |
ORPHA95698 |
Hyperplasie congénitale des surrénales par déficit en 21-hydroxylase non-classique |
1233 |
ORPHA91387 |
Anévrysme familial de l'aorte thoracique et dissection aortique |
1192 |
ORPHA60030 |
Syndrome de Loeys-Dietz type 1 |
1174 |
ORPHA85448 |
Amylose familiale type finlandais |
1169 |
ORPHA558 |
Syndrome de Marfan |
1151 |
ORPHA652 |
Néoplasie endocrinienne multiple type 1 |
1138 |
ORPHA640 |
Neuropathie héréditaire avec hypersensibilité à la pression |
1126 |
ORPHA406 |
Hypercholestérolémie familiale |
1064 |
ORPHA1934 |
Encéphalopathie épileptique infantile précoce |
1050 |
ORPHA101081 |
Maladie de Charcot-Marie-Tooth type 1A |
1047 |
ORPHA1885 |
Ectopie du cristallin familiale |
1046 |
ORPHA115 |
Arachnodactylie congénitale avec contractures |
1045 |
ORPHA284984 |
Syndrome d'arthrose-anévrisme |
1045 |
ORPHA846 |
Alpha-thalassémie |
1029 |
ORPHA636 |
Neurofibromatose type 1 |
1025 |
ORPHA357 |
Syndrome de Gilbert |
1018 |
ORPHA36383 |
Leucoencéphalopathie vasculaire familiale |
968 |
ORPHA399 |
Maladie de Huntington |
929 |
ORPHA101075 |
Maladie de Charcot-Marie-Tooth liée à l'X type 1 |
917 |
ORPHA300751 |
Cardiomyopathie dilatée familiale avec trouble de la conduction due à une mutation LMNA |
904 |
Figure POSTNATAL4. Répartition des maladies par nombre d'examens réalisés en 2015
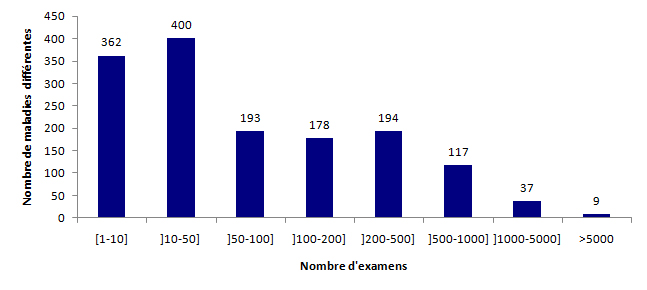
Tableau POSTNATAL17. Description de l'activité de génétique moléculaire postnatale
Tableau POSTNATAL18. Evolution de l'activité de diagnostic suite à un dépistage néonatal de la mucoviscidose
|
2011 |
2012 |
2013 |
2014 |
2015 |
Nombre de laboratoires ayant eu une activité de diagnostic suite à un dépistage néonatal de la mucoviscidose |
9 |
8 |
8 |
10 |
8 |
Nombre de nouveaux nés analysés |
3 231 |
3 430 |
3 145 |
2 890 |
2 589 |
Nombre de cas positifs rendus (2 mutations) |
154 |
92 |
73 |
137 |
109 |
Tableau POSTNATAL19. Evolution du pourcentage de laboratoires selon le nombre de diagnostics de génétique moléculaire proposés*
Nombre de diagnostics de génétique moléculaire proposés |
Laboratoires |
|||||||||
2011 |
2012 |
2013 |
2014 |
2015** |
||||||
N |
% |
N |
% |
N |
% |
N |
% |
N |
% |
|
1 à 2 |
57 |
32,2 |
51 |
29,3 |
53 |
29,6 |
46 |
26,3 |
47 |
26,7 |
3 à 10 |
55 |
31,1 |
53 |
30,5 |
58 |
32,4 |
59 |
33,7 |
58 |
33,0 |
11 à 20 |
28 |
15,8 |
30 |
17,2 |
26 |
14,5 |
27 |
15,4 |
20 |
11,4 |
21 à 35 |
22 |
12,4 |
21 |
12,1 |
22 |
12,3 |
22 |
12,6 |
20 |
11,4 |
36 à 100 |
14 |
7,9 |
18 |
10,3 |
19 |
10,6 |
19 |
10,9 |
27 |
15,3 |
> 100 |
1 |
0,6 |
1 |
0,6 |
1 |
0,6 |
2 |
1,1 |
4 |
2,3 |
Total |
177 |
100,0 |
174 |
100,0 |
179 |
100,0 |
175 |
100,0 |
176 |
100,0 |
*Diagnostics répertoriés dans la classification ORPHANET **En 2015, 178 laboratoires ont eu une activité de génétique moléculaire, 2 d’entre eux n’ont pas renseignés les diagnostics proposés dans leur laboratoire.
Figure POSTNATAL5. Répartition des examens en fonction de la quantité d'acide nucléique analysée en 2015
Activité de pharmacogénétique
La pharmacogénétique est l’étude du lien entre certaines caractéristiques génétiques constitutionnelles d’un individu et la réponse de l’organisme à un ou plusieurs médicaments. En 2015, 18 777 individus ont bénéficié d’un examen de pharmacogénétique et 47 laboratoires ont déclaré avoir réalisé ces examens.
Une augmentation continue du nombre d’examens de pharmacogénétique réalisés par les laboratoires est observée entre 2010 et 2013 (tableau POSTNATAL18). En 2014 le nombre d’examens réalisés diminue par rapport à l’année précédente avec 19 596 analyses. L’activité de 2015 est comparable à celle de 2014 avec 19 909 examens. Cette diminution est très probablement liée à une modification majeure du recueil de l’activité à partir de 2014. En effet, la classification utilisée les années précédentes a évolué pour avoir des données plus précises. Ainsi les situations où une même analyse pouvait être comptabilisée plusieurs fois par un laboratoire ont été quasiment supprimées.
Un travail continu est réalisé sur ce recueil afin de poursuivre l’amélioration de l’information. Il est primordial que les laboratoires soient en mesure de connaître l’indication pour laquelle ils réalisent un examen lorsqu’il peut y en avoir plusieurs (cas ou un même gène pourrait être impliqué dans plusieurs indications).
On peut observer que la réalisation d’examens « toxicité de l’abacavir » reste l’examen le plus réalisé en 2015 avec 7 464 tests soit 38% de l’ensemble des examens de pharmacogénétique (tableau POSTNATAL20 et tableau POSTNATAL21). La modification de la classification n’impacte pas cette indication, ni celle de la réponse au traitement anti-viral dans l'hépatite C (gène IL28B) qui voit son nombre d’examens chuter de plus du 73% entre 2013 et 2015. Pour ce dernier examen, la diminution de nombre de réalisations est directement liée à la diminution de la prescription du médicament pour lequel était fait ce test. Il devrait disparaitre avec l’apparition de nouveaux traitements de l’hépatite C.
Tableau POSTNATAL20. Evolution de l'activité de pharmacogénétique
|
2011 |
2012 |
2013 |
2014 |
2015 |
Nombre d'examens réalisés |
15 737 |
20 425 |
25 303 |
19 596 |
19 909 |
Nombre de laboratoires avec activité de pharmacogénétique |
35 |
44 |
47 |
53 |
47 |
Nombre de laboratoires ayant uniquement pratiqué une activité de pharmacogénétique |
3 |
5 |
5 |
5 |
5 |
* Une modification de la classification des indications de pharmacogénétique a été réalisée en 2014. Cette modification impacte le recueil de l’activité. Toute comparaison avec les années précédentes doit tenir compte de ce changement.
Tableau POSTNATAL21. Examens de pharmacogénétique effectués en 2015
ORPHA |
Indications* de l'examen |
Nombre |
Nombre de |
Nombre de |
Nombre de |
ORPHA240841 |
Toxicité de l'abacavir |
7 464 |
8 |
6 |
14 |
ORPHA240839 |
Toxicité des dérivés du fluorouracile |
3 315 |
9 |
2 |
10 |
ORPHA413687 |
Toxicité et adaptation posologique de l'azathioprine ou 6-mercaptopurine |
2 433 |
16 |
3 |
19 |
ORPHA240885 |
Toxicité de l'irinotécan |
1 796 |
15 |
1 |
16 |
ORPHA241043 |
Adaptation posologique du tacrolimus |
1 719 |
10 |
2 |
12 |
ORPHA240863 |
Toxicité du cisplatine |
1 662 |
10 |
2 |
12 |
ORPHA284102 |
Réponse au traitement anti-viral dans l'hépatite C |
889 |
14 |
0 |
14 |
ORPHA413667 |
Toxicité et adaptation posologique des antidépresseurs ou antipsychotiques |
839 |
5 |
2 |
7 |
ORPHA240935 |
Résistance au clopidogrel |
438 |
6 |
1 |
7 |
ORPHA240921 |
Toxicité du voriconazole |
424 |
6 |
1 |
7 |
ORPHA413674 |
Toxicité et adaptation posologique des anti-vitamines K |
381 |
8 |
5 |
9 |
ORPHA240945 |
Résistance au tacrolimus dans la transplantation |
377 |
3 |
0 |
3 |
ORPHA240905 |
Toxicité du raltegravir |
240 |
6 |
1 |
7 |
ORPHA413684 |
Résistance aux anti-vitamine K |
216 |
3 |
4 |
7 |
ORPHA240947 |
Résistance au tamoxifène |
207 |
3 |
1 |
4 |
ORPHA240867 |
Toxicité de la codéine |
138 |
2 |
1 |
3 |
ORPHA284113 |
Susceptibilité aux effets indésirables graves de la mercaptopurine |
133 |
2 |
0 |
2 |
ORPHA413693 |
Toxicité des curarisants |
71 |
0 |
3 |
3 |
ORPHA413690 |
Toxicité et adaptation posologique du méthotrexate |
48 |
4 |
2 |
6 |
ORPHA413696 |
Toxicité des statines |
40 |
0 |
1 |
1 |
ORPHA240925 |
Choix du dosage de l'azathioprine dans le traitement de la maladie de Crohn, de la leucémie et dans la transplantation |
37 |
1 |
0 |
1 |
ORPHA413681 |
Surdosage ou adaptation posologique des hypoglycémiants oraux |
37 |
1 |
1 |
2 |
ORPHA240887 |
Toxicité de l'isoniazide |
24 |
2 |
1 |
3 |
ORPHA284121 |
Toxicité ou non réponse au clozapine |
18 |
2 |
1 |
3 |
ORPHA240869 |
Toxicité de l'efavirenz |
16 |
2 |
1 |
3 |
ORPHA240973 |
Susceptibilité aux effets indésirables graves de l'irinotécan |
15 |
0 |
1 |
1 |
ORPHA240955 |
Susceptibilité aux effets indésirables graves du 5-fluorouracile |
6 |
1 |
0 |
1 |
ORPHA240889 |
Toxicité de la mercaptopurine |
4 |
1 |
0 |
1 |
*Indications répertoriées dans la classification Orphanet
**Analyse de niveau 1 : Recherche des mutations les plus fréquentes dont la causalité pour la maladie étudiée est clairement démontrée. La technique utilisée est généralement simple et souvent basée sur des dispositifs spécifiquement établis pour une recherche ciblée.
Analyse de niveau 2:L’analyse du gène est exhaustive, la technique peut être simple ou complexe. Toute technique de balayage pour rechercher des mutations inconnues rentre dans ce cadre à l’exception des examens réalisés par NGS.
Tableau POSTNATAL22. Evolution du nombre d'examens de pharmacogénétique
ORPHA |
Indications* de l'examen |
2011 |
2012 |
2013 |
2014 |
2015 |
ORPHA240841 |
Toxicité de l'abacavir |
3395 |
3900 |
6417 |
6707 |
7464 |
ORPHA240839 |
Toxicité des dérivés du fluorouracile |
2442 |
3871 |
3643 |
3387 |
3315 |
ORPHA413687 |
Toxicité et adaptation posologique de l'azathioprine ou 6-mercaptopurine |
1515 |
2257 |
3084 |
2091 |
2433 |
ORPHA240885 |
Toxicité de l'irinotécan |
1757 |
1996 |
2283 |
1784 |
1796 |
ORPHA241043 |
Adaptation posologique du tacrolimus |
1103 |
1829 |
1351 |
1720 |
1719 |
ORPHA240863 |
Toxicité du cisplatine |
. |
. |
586 |
43 |
1662 |
ORPHA284102 |
Réponse au traitement anti-viral dans l'hépatite C |
3339 |
4292 |
4287 |
2215 |
889 |
ORPHA413667 |
Toxicité et adaptation posologique des antidépresseurs ou antipsychotiques |
366 |
436 |
1373 |
614 |
839 |
ORPHA240935 |
Résistance au clopidogrel |
90 |
106 |
124 |
84 |
438 |
ORPHA240921 |
Toxicité du voriconazole |
6 |
9 |
24 |
29 |
424 |
ORPHA413674 |
Toxicité et adaptation posologique des anti-vitamines K |
209 |
622 |
519 |
678 |
381 |
ORPHA240945 |
Résistance au tacrolimus dans la transplantation |
. |
. |
. |
. |
377 |
ORPHA240905 |
Toxicité du raltegravir |
3 |
. |
37 |
1 |
240 |
ORPHA413684 |
Résistance aux anti-vitamine K |
81 |
138 |
115 |
37 |
216 |
ORPHA240947 |
Résistance au tamoxifène |
64 |
12 |
48 |
4 |
207 |
ORPHA240867 |
Toxicité de la codéine |
. |
. |
48 |
1 |
138 |
ORPHA284113 |
Susceptibilité aux effets indésirables graves de la mercaptopurine |
. |
. |
. |
. |
133 |
ORPHA413693 |
Toxicité des curarisants |
26 |
144 |
228 |
11 |
71 |
ORPHA413690 |
Toxicité et adaptation posologique du méthotrexate |
137 |
61 |
94 |
44 |
48 |
ORPHA413696 |
Toxicité des statines |
86 |
181 |
42 |
3 |
40 |
ORPHA240925 |
Choix du dosage de l'azathioprine dans le traitement de la maladie de Crohn, de la leucémie et dans la transplantation |
. |
. |
. |
. |
37 |
ORPHA413681 |
Surdosage ou adaptation posologique des hypoglycémiants oraux |
. |
29 |
190 |
1 |
37 |
ORPHA240887 |
Toxicité de l'isoniazide |
27 |
55 |
40 |
19 |
24 |
ORPHA284121 |
Toxicité ou non réponse au clozapine |
1 |
2 |
12 |
22 |
18 |
ORPHA240869 |
Toxicité de l'efavirenz |
505 |
60 |
83 |
80 |
16 |
ORPHA240973 |
Susceptibilité aux effets indésirables graves de l'irinotécan |
. |
. |
. |
. |
15 |
ORPHA240955 |
Susceptibilité aux effets indésirables graves du 5-fluorouracile |
. |
. |
. |
. |
6 |
ORPHA240889 |
Toxicité de la mercaptopurine |
. |
. |
. |
. |
4 |
ORPHA241017 |
Susceptibilité à l'ictère dans le traitement par le raltegravir |
4 |
4 |
299 |
. |
. |
* Indications répertoriées dans la classification Orphanet