L’AMP vigilance est une vigilance sanitaire réglementée confiée à l’Agence de la biomédecine par la loi n°2004-800 du 6 août 2004 relative à la bioéthique. Le décret de juin 20081 a complété l’organisation du dispositif et précisé les rôles des différents acteurs. La loi n°2011-814 du 7 juillet 2011 relative à la bioéthique n’a pas introduit de modifications dans ce champ.
L’AMP vigilance a pour objet la surveillance des incidents relatifs aux gamètes, aux tissus germinaux et aux embryons utilisés à des fins d’assistance médicale à la procréation ou à des fins de préservation de la fertilité, ainsi que des effets indésirables observés chez les donneurs de gamètes ou chez les personnes qui ont recours à l’assistance médicale à la procréation.
On entend par incident tout accident ou erreur survenant au cours des différentes étapes du processus d’AMP, susceptible d’entraîner un effet indésirable sur la personne ou la perte de gamètes, de tissus germinaux ou d’embryons. À titre d’exemple, des incidents à type de perte partielle ou totale d’embryons liée à un matériel défectueux (ex : panne de congélateur) ou de problèmes d’étiquetage des tubes de liquide folliculaire ont été rapportés.
On entend par effet indésirable toute réaction nocive survenant chez une personne liée ou susceptible d’être liée aux activités d’AMP au cours de ses différentes étapes (stimulation, ponction folliculaire, insémination, transfert embryonnaire). À titre d’exemple, des effets indésirables à type d’hyperstimulations ovariennes sévères, d’hémopéritoine, et d’accidents thromboemboliques ont été rapportés.
Chaque centre autorisé pour les activités d’AMP doit désigner un correspondant local d’AMP vigilance (CLA). Ce dernier a pour missions de recueillir tous les incidents et les effets indésirables, de les déclarer sans délai à l’Agence de la biomédecine, d’informer les autres correspondants locaux d’AMP vigilance si nécessaire et les autres vigilances sanitaires concernées de son établissement, de participer aux investigations, d’aviser l’Agence de la biomédecine des résultats des investigations et en cas de difficultés de fonctionnement du dispositif. Tout autre professionnel qui ne dépend pas d’un centre d’AMP et qui a connaissance de la survenue d’un événement indésirable doit en informer sans délai l’Agence de la biomédecine. En pratique, il est préférable que ce professionnel de santé en informe le centre d’AMP dans lequel le couple a été pris en charge initialement et que le CLA fasse la déclaration de l’événement indésirable.
Fin 2011, le réseau d’AMP vigilance comprend 194 correspondants locaux d’AMP vigilance désignés dans 95 % des 205 centres d’AMP répartis en 109 centres clinico-biologiques et en 96 laboratoires pratiquant uniquement l’insémination artificielle.
Les déclarations d’AMP vigilance sont évaluées et expertisées par l’Agence de la biomédecine en lien avec un groupe de travail externe “AMP vigilance” composé d’experts biologistes et gynécologues-obstétriciens spécialisés dans le domaine de l’AMP. L’Agence de la biomédecine a la possibilité de proposer ou de mettre en œuvre des mesures préventives et/ou correctives dans un but de réduction des risques et d’amélioration des pratiques. L’Agence de la biomédecine assure le secrétariat de la commission nationale d’AMP vigilance.
L’AMP vigilance comporte une dimension transversale forte, impliquant souvent d’autres systèmes de vigilance sanitaire, notamment la matériovigilance, la pharmacovigilance. Ceci a justifié le développement de procédures d’échanges des données avec ces systèmes de vigilance sanitaires pilotés par l’Afssaps.
Les correspondants locaux d’AMP vigilance, de par leurs missions déclarent les incidents et/ou effets indésirables à l’Agence de la biomédecine au moyen de la fiche de déclaration.
Ces fiches sont envoyées par fax, mail, courrier ou directement saisies dans l’application sécurisée AMP Vigie, via un portail sécurisé qui permet aux correspondants locaux d’AMP vigilance de déclarer en ligne les incidents et effets indésirables en AMP.
Bilan des déclarations d’AMP vigilance
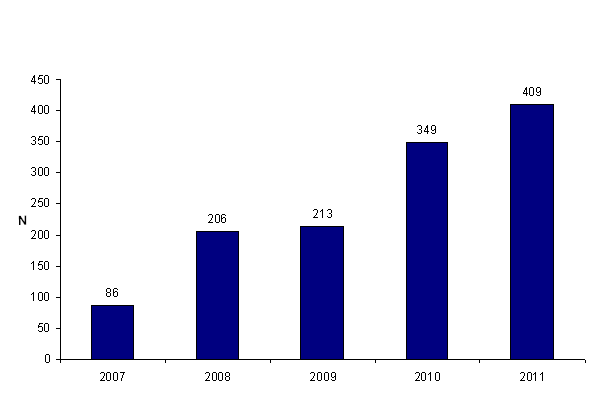
Le nombre de déclarations a augmenté de façon importante entre 2007 et 2011, témoignant de la montée en charge du dispositif (Fig. AMPV1). Cette augmentation apparente des déclarations témoigne d’une appropriation progressive du dispositif par les professionnels de l’AMP et d’un développement de la culture du signalement chez les professionnels. Elle ne traduit probablement pas une augmentation réelle des déclarations mais plutôt un développement de la notification. Il est précisé que jusqu’à la fin de l’année 2009, les déclarations sont comptabilisées par rapport à la date de survenue de l'événement et non par rapport à la date de notification alors que depuis le 1er janvier 2010, les déclarations sont comptabilisées suivant la date de notification à l’Agence de la biomédecine.
Figure AMPV1. Évolution du nombre de déclarations d'AMP vigilance entre 2007 et 2011
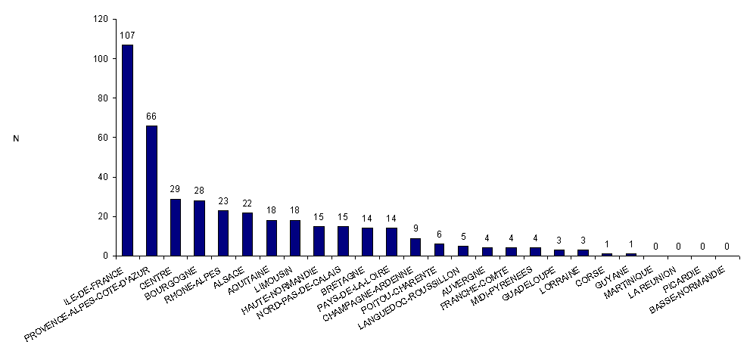
Distribution des déclarations d’AMP vigilance par région
En 2011, 78 centres d’AMP (centres clinico-biologiques d’AMP ou laboratoires d’IA) répartis dans 22 régions ont transmis au moins une déclaration d’AMP vigilance à l’Agence de la biomédecine. Dans 4 régions (Martinique, Réunion, Picardie et Basse-Normandie) les centres d’AMP n’ont fait aucune déclaration. Dans les autres régions, en moyenne près de 19 déclarations d’AMP vigilance ont été faites par région et par an avec des extrêmes compris entre 1 et 107 déclarations (Fig AMPV2).
Figure AMPV2. Nombre de déclarations d'AMP vigilance en fonction des régions (n = 409, 2011)
Distribution des incidents et des effets indésirables en fonction de la gravité
En 2011, 343 événements soit près de 84 % des incidents et des effets indésirables sont cotés comme graves2 (G3, G4, G5) (Tableau AMPV1 et Fig AMPV3). On remarque que la plupart des effets indésirables (94 %) sont cotés comme graves alors que la plupart des incidents (62 %) sont cotés comme non graves.
Il existe 5 niveaux de gravité G1 à G5 présentés ci-dessous :
|
G1 |
Diminution de la performance du processus, sans conséquence sur son résultat, et/ou source de contrainte opérationnelle acceptable |
|
G2 |
Dégradation de la performance du processus susceptible ou ayant altéré de façon modérée son résultat et/ou source de contrainte opérationnelle non acceptable Perte d'embryons et/ou de gamètes sans disparition des chances de procréation sur la tentative |
|
G3 |
Dégradation de la performance du processus ayant altéré de façon importante son résultat. Complications liées au processus d’AMP avec hospitalisation supérieure à 24h et/ou incapacité fonctionnelle mineure Intervention médicale ou chirurgicale afin d’exclure tout dommage permanent ou infirmité corporelle Risque de transmission d’affection(s) à morbidité modérée accessible(s) à un traitement Perte d’embryons et/ou des gamètes avec disparition des chances de procréation sur la tentative |
|
G4 |
Acte ou procédure sur un patient autre (erreur d’attribution) Perte d’embryons et/ou des gamètes avec disparition définitive des chances de procréation pour le couple Complications sévères liées au processus d’AMP avec hospitalisation supérieure à 7 jours et/ou incapacité fonctionnelle majeure Risque de transmission par les gamètes d’affection(s) à morbidité sévère : affections transmissibles avec mise en jeu du pronostic vital |
|
G5 |
Décès au cours du processus d’AMP Incapacité fonctionnelle majeure et permanente |
Tableau AMPV T1. Nombre d'incidents et d'effets indésirables en fonction de la gravité (n=409, 2011)
Niveau de gravité |
Total |
Non graves |
Graves |
||||||||
|
G1 |
G2 |
G3 |
G4 |
G5 |
||||||
n |
n |
% |
n |
% |
n |
% |
n |
% |
n |
% |
|
Incidents |
76 |
9 |
11,8 |
38 |
50,0 |
21 |
27,6 |
8 |
10,5 |
0 |
0,0 |
Effets indésirables |
333 |
3 |
0,9 |
16 |
4,8 |
226 |
67,9 |
87 |
26,1 |
1 |
0,3 |
Total |
409 |
12 |
2,9 |
54 |
13,2 |
247 |
60,4 |
95 |
23,2 |
1 |
0,2 |
Les 409 déclarations d’AMP vigilance de l’année 2011 sont réparties en 333 effets indésirables et en 76 incidents. La proportion d’événements graves est de l’ordre de 84 %, similaire aux années précédentes (Fig AMPV3).
Figure AMPV3. Nombre d'incidents et d'effets indésirables en fonction de la gravité (n = 409, 2011)
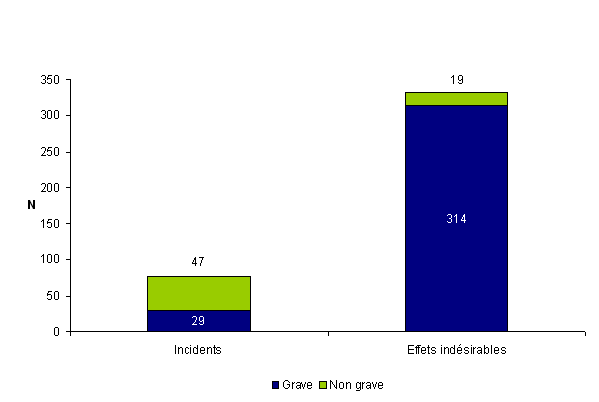
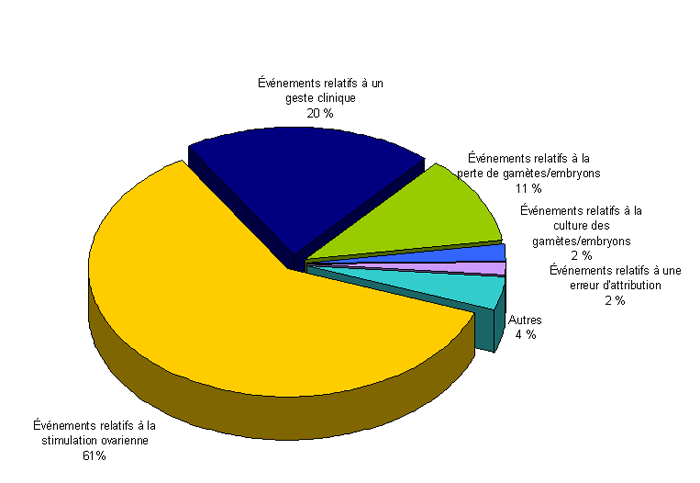
Distribution des incidents et des effets indésirables en fonction de la typologie et de la gravité
Pour l’année 2011, 248 événements indésirables (61 %) sont relatifs à la stimulation ovarienne, 84 (20 %) sont relatifs à un geste clinique lors de l’AMP (inséminations, ponctions, transferts), 44 (11 %) sont relatifs à la perte de gamètes/embryons, 9 (2 %) sont relatifs à la culture des gamètes/embryons, 7 (2 %) sont relatifs à une erreur d'attribution ou d’identification des gamètes/embryons, et 17 classés comme autres (4 %) (Fig AMPV4).
Figure AMPV4. Distribution des incidents et/ou des effets indésirables en fonction de la typologie (n = 409, 2011)
Événements relatifs à la stimulation ovarienne
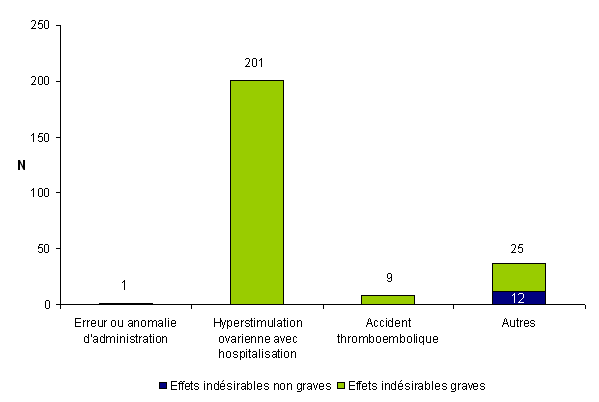
Environ 61 % des événements indésirables rapportés en 2011 concernent des événements relatifs à la stimulation ovarienne (n = 248) (Fig AMPV5). Ces 248 événements indésirables comprennent uniquement des effets indésirables, cotés comme graves pour la plupart (95 %). Il s’agit le plus souvent de syndromes d’hyperstimulation ovarienne sévères avec hospitalisation (201/248 soit 81 %). Dans 9 cas des thromboses ont été rapportées chez des femmes âgées en moyenne de 37 ans [31-42]. Il s’agit de 3 cas d’embolie pulmonaire, de 3 cas de thromboses jugulaires internes, de 2 cas de thromboses du membre supérieur gauche et d’1 accident ischémique transitoire. Dans 4 observations, un syndrome d’hyperstimulation ovarienne était associé.
Figure AMPV5. Distribution des effets indésirables relatifs à la stimulation ovarienne en fonction de la gravité (n = 248, 2011)
Événements relatifs à un geste clinique lors de l’AMP
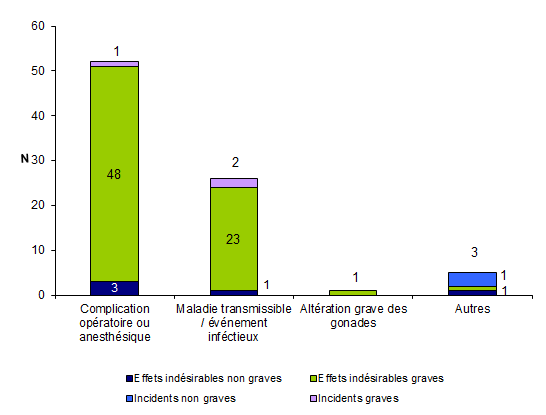
En 2011, 84 événements indésirables (20 %) sont en lien avec un geste clinique lors de l’AMP (insémination, ponction folliculaire, transfert embryonnaire, ...). Ces événements sont répartis en 78 effets indésirables (73 effets indésirables graves et 5 effets indésirables non graves) et 6 incidents (3 incidents graves et 3 incidents non graves).
Parmi les événements associés à un geste clinique lors de l’AMP, la plupart (52/84 soit 62 %) concernent des complications postopératoires (ex : hémopéritoine, hématomes, …) ou d’anesthésie, et 31 % des infections (Fig AMPV6).
Figure AMPV6. Nombre d'incidents et d'effets indésirables relatifs à un geste clinique lors de l'AMP en fonction de la gravité (n = 84, 2011)
Événements relatifs à une perte de gamètes / embryons
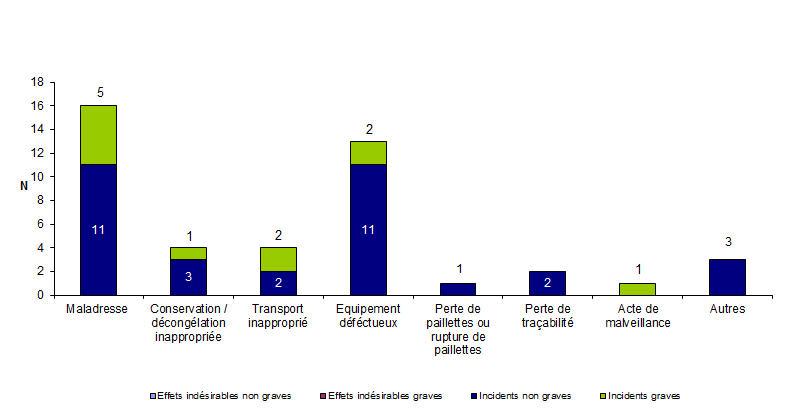
Quarante quatre (11 %) événements indésirables rapportés en 2011 concernent des événements relatifs à la perte ou destruction accidentelle des gamètes ou des embryons. Il s’agit uniquement d’incidents non graves le plus souvent (73 %). La plupart de ces incidents (66 %) sont en rapport avec une maladresse ou avec un équipement ou un matériel défectueux (Fig AMPV7).
Figure AMPV7. Nombre d'incidents relatifs à la perte ou à la destruction accidentelle de gamètes/embryons en fonction de la gravité (n = 44, 2011)
Distribution des incidents et des effets indésirables en fonction de l’imputabilité
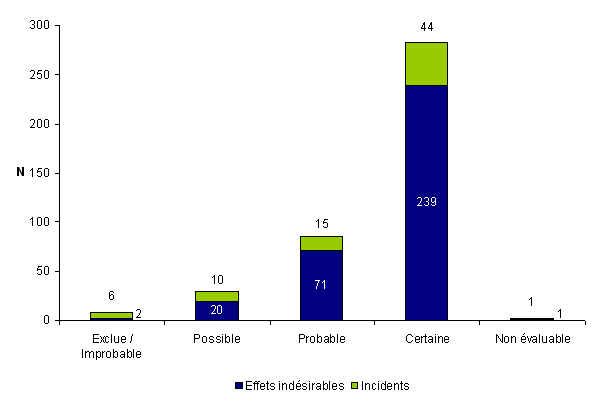
Selon la fiche de déclaration d’AMP vigilance et la méthodologie développée dans le guide d’aide à la mise en place du dispositif d’AMP vigilance, le déclarant doit évaluer l’imputabilité de l’incident ou de l’effet indésirable selon une échelle d’imputabilité proposée par l’Agence de la biomédecine. L’imputabilité consiste en l’analyse de la relation causale entre la survenue d’un événement indésirable observé et un autre événement survenu en amont susceptible d’en être la cause. Il s’agit d’une estimation individuelle pour une déclaration donnée de la probabilité de la relation existante entre le processus d’AMP et la survenue d’un incident ou d’un effet indésirable. L’ensemble des étapes du processus d’AMP et leur environnement doivent être pris en compte. Il peut y avoir une différence entre le niveau d’imputabilité établi lors de la survenue de l’événement indésirable et celui retenu après investigation du cas. Il s’agit donc d’une estimation initiale qui sera réévaluée et modifiée si besoin par le CLA dans la partie B de la fiche de déclaration. Après réception de la déclaration, l’Agence de la biomédecine réévalue le niveau d’imputabilité pour s’assurer d’une utilisation cohérente de l’échelle ou attribue une imputabilité à cet événement si cela n’a pas déjà été fait par le déclarant. La distribution des déclarations en fonction de l’imputabilité est présentée à la figure AMPV8.
Figure AMPV8. Distribution des incidents et des effets indésirables en fonction de l’imputabilité (n = 409, 2011)
Pour plus d’informations, le rapport annuel d’AMP vigilance 2011 adressé au ministre en charge de la santé est téléchargeable à partir de juillet 2012 sur le site de l’Agence de la biomédecine (http://www.agence-biomedecine.fr/professionnels/amp-vigilance.html)
1 Décret n°2008-588 du 19 juin 2008 transposant en matière de don de gamètes et d’assistance médicale à la procréation la directive 2004/23/CE du Parlement européen et du Conseil du 31 mars 2004
2 Un effet indésirable est considéré comme grave s’il est susceptible d’entraîner la mort ou de mettre la vie en danger, d’entraîner une invalidité ou une incapacité, de provoquer ou de prolonger une hospitalisation ou tout autre état morbide ou susceptible de se reproduire chez un ou plusieurs donneurs ou personnes qui ont recours à l’assistance médicale à la procréation.
Un incident est considéré comme grave s’il est susceptible d’entraîner des effets indésirables graves. Est également considéré comme incident grave tout incident susceptible d’occasionner une erreur d’attribution ou une perte de gamètes, tissus germinaux ou embryons avec perte de chance totale de procréation sur la tentative ou pour le couple.
