Définitions
La biovigilance, mise en place par le décret n°2003-1206 du 12 décembre 2003, a pour objet la surveillance des incidents et des risques d'incidents relatifs aux éléments et produits du corps humain tels les organes, les tissus, les cellules et le lait maternel utilisés à des fins thérapeutiques ainsi que des effets indésirables résultant de leur utilisation par le biais de notifications spontanées effectuées par les correspondants locaux.
On entend par incident tout accident ou erreur lié aux activités entrant dans le champ de compétence de la biovigilance, susceptible d'entraîner un effet indésirable chez le patient, le donneur vivant ou le receveur (exemple : non-respect des conditions de transport, contamination par agent fongique du liquide de conservation). Un incident grave est un incident susceptible d'entraîner des effets indésirables graves.
On entend par effet indésirable toute réaction nocive survenant chez un patient, un donneur vivant ou un receveur, liée ou susceptible d'être liée à un produit ou à une activité entrant dans le champ de la biovigilance (exemple : infection potentiellement transmise par le greffon, thrombose vasculaire aboutissant à une détransplantation).
Un effet indésirable grave est un effet susceptible d'entraîner la mort ou de mettre la vie en danger, d'entraîner une invalidité ou une incapacité, ou de provoquer ou de prolonger une hospitalisation ou tout autre état morbide, ou susceptible de se reproduire chez un ou plusieurs patients, donneurs vivants ou receveurs.
Dispositif de biovigilance
L’ANSM est l’autorité compétente en matière de biovigilance (Art. R-1211-33 du code de la santé publique (CSP), http://www.ansm.sante.fr/)1. Pour assurer le bon fonctionnement du système national de biovigilance, l'ANSM s'appuie sur un réseau de structures qui inclut notamment l’Agence de la biomédecine (Art. R-1211-32 du CSP), les établissements de santé et des correspondants locaux de biovigilance (CLB) dont les missions sont définies réglementairement (Art. R.1211-42 à R.1211-45 du CSP). L’Agence de la biomédecine dispose également d’un correspondant local de biovigilance.
Le CLB de l’Agence de la biomédecine est destinataire de l’ensemble des déclarations de biovigilance et des éléments d’informations qui s’y rapportent (Art. R-1211-42 du CSP). L’Agence de la biomédecine joue un rôle important en ce qui concerne le recueil, et l’analyse des déclarations des événements indésirables relevant de la biovigilance dans le champ des organes ainsi qu’en matière de gestion des risques (revue analytique des cas déclarés en biovigilance en comité interne de vigilance, rappel de la réglementation auprès des équipes, développement d’outils d’exploitation, rédaction de recommandations professionnelles).
Données 2015
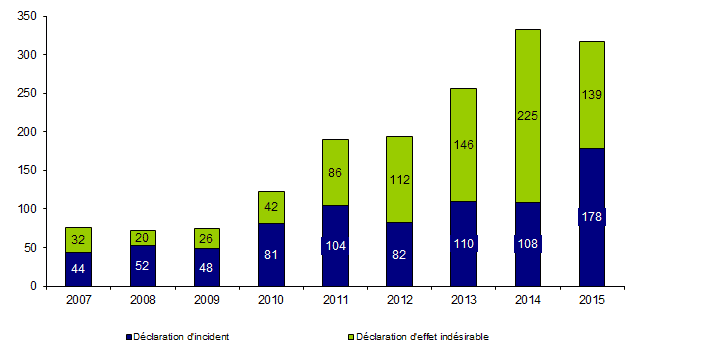
Le nombre de déclarations d’incidents et d’effets indésirables déclarés en 2015 par le dispositif de biovigilance et concernant le prélèvement et la greffe d’organes est de 317 (versus 333 en 2013). Les déclarations se répartissent en 178 déclarations d’incidents et 139 déclarations d’effets indésirables (Figure BIOV1). Il convient également de noter que 1307 liquides de conservation contaminés (à bactéries) ont été recensés mais n’ont pas fait l’objet de déclarations au fil du temps conformément aux dispositions fixées entre l’ANSM et l’Agence de la biomédecine dans l’attente de disposer d’un système d’information permettant de traiter cette masse de données.
Des informations complémentaires sont disponibles dans le rapport annuel de synthèse de biovigilance de l’Agence de la biomédecine 2015 (site des professionnels : http://www.agence-biomedecine.fr/Biovigilance).
Figure BIOV1. Evolution du nombre de déclarations d’incidents et d’effets indésirables (2007-2015)
Les effets indésirables graves2 (G3, G4, G5) correspondent à 98% des déclarations reçues en 2015 (Tableau BIOV1).
Tableau BIOV1. Distribution des déclarations d’effets indésirables en fonction de la gravité
| Gravité | Gravité 1 | Gravité 2 | Gravité 3 | Gravité 4 | Gravité 5 | Total |
| N | 0 | 2 | 30 | 35 | 72 | 139 |
| % | 0,0% | 1,4% | 21,6% | 25,2% | 51,8% | 100,0% |
La gravité est déterminée par le déclarant au vu de l’intensité de l’effet indésirable lors de la déclaration initiale et secondairement lors de la clôture de la déclaration au vu des résultats de l’investigation finale.
Déclarations d’incidents au cours de l’année 2015
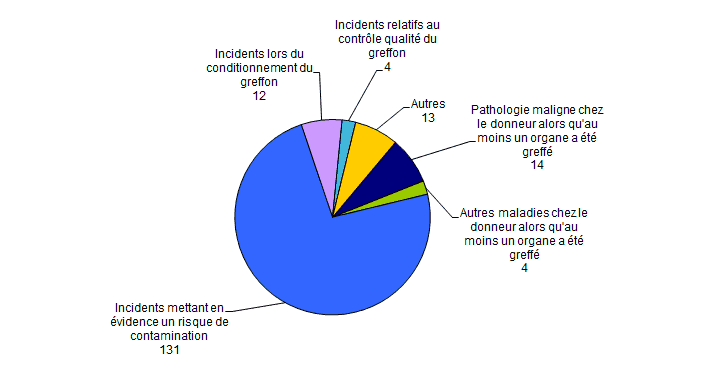
On dénombre (Figure BIOV2) :
- 14 déclarations ayant trait à la découverte de pathologie maligne chez le donneur alors qu’au moins un organe a été greffé ;
- 13 déclarations de typologies diverses classées autres ;
- 12 déclarations d’incidents lors du conditionnement du greffon ;
- 4 déclarations « d’autres maladies » chez le donneur dont au moins un organe a été greffé ;
- 4 déclarations d’incidents relatifs au contrôle qualité du greffon ;
- 131 déclarations mettant en évidence un risque de contamination.
Figure BIOV2. Nombre de déclarations d’incidents par typologie (n=178, 2015)
Déclarations d’effets indésirables au cours de l’année 2015
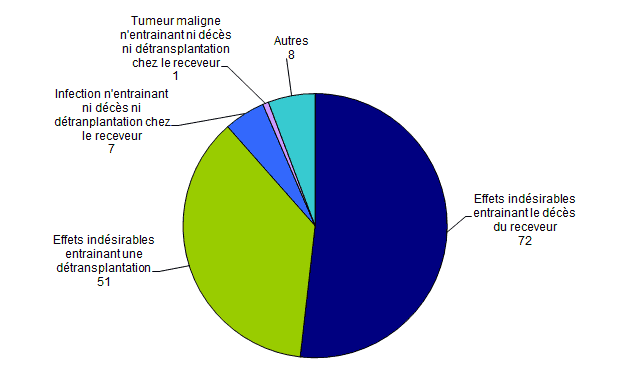
On dénombre (Figure BIOV3) :
- 72 déclarations d’effets indésirables entrainant le décès du receveur dont 22 déclarations d’effets indésirables de nature infectieuse et 32 déclarations d’effets indésirables de nature cardiovasculaire (hémorragies, thromboses vasculaires,…) ;
- 51 déclarations d’effets indésirables entrainant une détransplantation dont 39 déclarations d’effets indésirables de nature cardiovasculaire (hémorragies, thromboses vasculaires,…) ;
- 8 déclarations de typologies diverses classées autres ;
- 7 déclarations d’infections n’entrainant pas de décès ou de détransplantation chez le receveur ;
- 1 déclaration de tumeur maligne chez le receveur n’entraînant pas de décès ni de détransplantation.
Figure BIOV3. Nombre de déclarations d’effets indésirables par typologie (n=139, 2015)
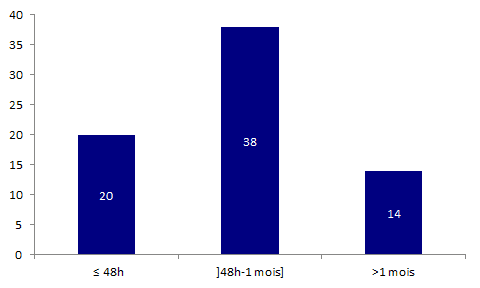
72 déclarations d’effets indésirables ont entrainé le décès du receveur, leur répartition selon le délai de survenu du décès par rapport à l’acte de greffe est présentée dans la figure BIOV4 ci-dessous.
Figure BIOV4. Répartition des déclarations d'effets indésirables ayant entrainé un décès selon le délai de survenu du décès par rapport à l'acte de greffe
- Parmi ces 72 déclarations, 22 étaient la conséquence d’événements de nature infectieuse. Leur répartition par organe est présentée dans la figure BIOV5 ci-dessous.
Figure BIOV5. Répartition des déclarations d'effets indésirables de nature infectieuse ayant entrainé un décès selon l’organe greffé.
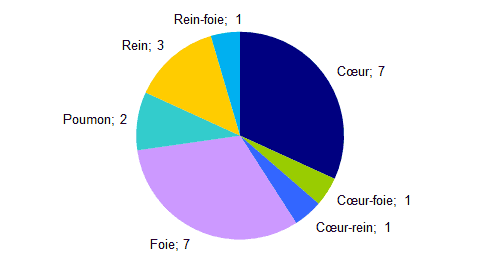
À noter :
- un décès d’un receveur de rein est secondaire à une septicémie à Enterococcus faecalis et une endocardite des valves aortique, mitrale et tricuspidienne (greffe rénale pour insuffisance rénale terminale sur glomérulonéphrite membrano-proliférative, liquide de conservation du rein non contaminé).
- un décès d’un receveur de rein est lié à une décompensation respiratoire aiguë sur pneumopathie bilatérale d’origine virale, virus Influenza A H1N1.
- un décès d’un receveur de rein est lié à une détresse respiratoire dans un contexte de pneumopathie franche lobaire aiguë.
- un décès d’un receveur de pancréas est associé à une collection péripancréatique fistulisée.
- Parmi ces 72 déclarations, 32 étaient la conséquence d’événements de nature cardiovasculaire. Leur répartition par organe est présentée dans la figure BIOV6 ci-dessous.
Figure BIOV6. Répartition des déclarations d'effets indésirables de nature cardiovasculaire ayant entrainé un décès selon l’organe greffé.
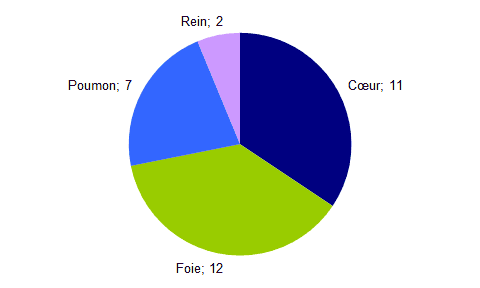
Il est a noté que 44% (32/72) des déclarations d’effets indésirables ayant entrainé un décès chez le receveur concernent des événements de nature cardiovasculaire. Parmi celles-ci, 50% (16/32) concernent des hémorragies et 16% (5/32) concernent des thromboses artérielles ou veineuses.
Les deux décès dans ce contexte concernant des receveurs de rein font suite, pour l’un, à une ischémie digestive par collapsus associée à deux épisodes de bradychardie extrême (troisième transplantation) et pour l’autre, à des thromboses successives en lien avec la pathologie auto-immune du receveur.
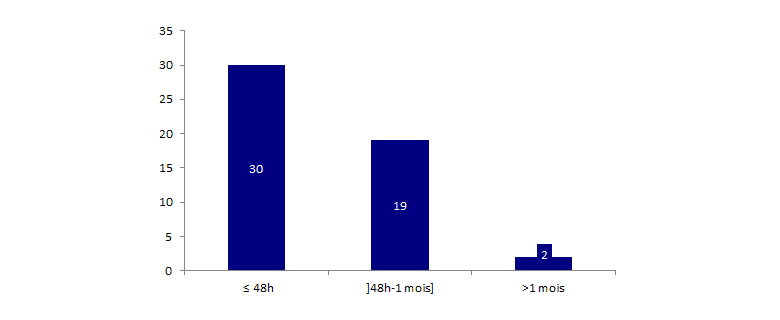
51 déclarations d’effets indésirables ont entrainé une détransplantation, leur répartition selon le délai de survenu de la détransplantation par rapport à l’acte de greffe est présenté dans la figure BIOV7 ci-dessous.
Figure BIOV7. Répartition des déclarations d'effets indésirables ayant entrainé une détransplantation selon le délai de survenu de la détransplantation par rapport à l'acte de greffe
1 Il convient de noter que la loi du 26 janvier 2016 sur la modernisation du système de santé prévoit le transfert de la biovigilance à l’agence de la biomédecine, le transfert de compétence doit entrer en vigueur à la date de la publication du décret d’application.
2 Echelle de gravité :
1-Négligeable : Manifestations cliniques ou biologiques ne nécessitant aucune prise en charge ou traitement médical.
2-Modérée : Manifestations cliniques ou biologiques sans menace vitale à court ou long terme et ne nécessitant pas d’hospitalisation.
3-Sévère : Manifestations cliniques ou biologiques entraînant une invalidité ou une incapacité, ou provoquant, prolongeant ou compliquant une hospitalisation ou tout autre état morbide, ou nécessitant une intervention médicale ou chirurgicale pour éviter un dommage permanent ou la défaillance d’une fonction corporelle.
A noter : les infections sévères susceptibles d’avoir été transmises par le produit biologique ou les activités de prélèvement ou de greffe/administration doivent systématiquement être déclarées et ceci à un niveau de gravité supérieur ou égal à 3.
4-Majeure : Menace vitale immédiate.
5-Décès.