Définitions
L’AMP vigilance a pour objet la surveillance des incidents relatifs aux gamètes, aux tissus germinaux et aux embryons utilisés à des fins d’assistance médicale à la procréation, ainsi que des effets indésirables observés chez les donneurs de gamètes ou chez les personnes qui ont recours à l’assistance médicale à la procréation. Cette surveillance repose à ce jour sur un système de notifications spontanées.
On entend par incident tout accident ou erreur survenant au cours des différentes étapes du processus d’AMP, susceptible d’entraîner un effet indésirable sur la personne ou entrainant la perte de gamètes, de tissus germinaux ou d’embryons. À titre d’exemple, des incidents à type de perte totale d’embryons liée à un matériel défectueux (ex : panne de congélateur) ou de problèmes d’étiquetage des tubes de liquide folliculaire ont été rapportés.
On entend par effet indésirable toute réaction nocive survenant chez une personne, liée ou susceptible d’être liée aux activités d’AMP au cours de ses différentes étapes (stimulation, ponction folliculaire, insémination, transfert embryonnaire). À titre d’exemple, des effets indésirables à type d’hyperstimulations ovariennes sévères, d’hémopéritoines, et d’accidents thromboemboliques ont été rapportés.
Dispositif d’AMP vigilance
L’AMP vigilance est une vigilance sanitaire réglementée confiée à l’Agence de la biomédecine par la loi n°2004-800 du 6 août 2004 relative à la bioéthique. Le décret de juin 20081 a complété l’organisation du dispositif et précisé les rôles des différents acteurs. La loi n°2011-814 du 7 juillet 2011 relative à la bioéthique n’a pas introduit de modifications dans ce champ.
Chaque centre autorisé pour les activités d’AMP doit désigner un correspondant local d’AMP vigilance (CLA). Ce dernier a pour missions de recueillir tous les incidents et les effets indésirables, de les déclarer sans délai à l’Agence de la biomédecine, d’informer les autres correspondants locaux d’AMP vigilance si nécessaire et les autres vigilances sanitaires concernées de son établissement, de participer aux investigations, d’aviser l’Agence de la biomédecine des résultats des investigations et en cas de difficultés de fonctionnement du dispositif. Tout autre professionnel qui ne dépend pas d’un centre d’AMP et qui a connaissance de la survenue d’un incident et d’un effet indésirable doit en informer sans délai l’Agence de la biomédecine. En pratique, il est préférable que ce professionnel de santé en informe le centre d’AMP dans lequel le couple a été pris en charge initialement et que le CLA fasse la déclaration de l’événement indésirable.
Fin 2014, le réseau d’AMP vigilance comprenait 190 correspondants locaux désignés dans 100 % des centres d’AMP autorisés.
Les déclarations d’AMP vigilance sont évaluées et expertisées par l’Agence de la biomédecine en lien avec un groupe de travail externe “AMP vigilance” composé d’experts biologistes et gynécologues-obstétriciens spécialisés dans le domaine de l’AMP. L’Agence de la biomédecine a la possibilité de proposer ou de mettre en œuvre des mesures préventives et/ou correctives dans un but de réduction des risques et d’amélioration des pratiques. L’Agence de la biomédecine assure le secrétariat de la commission nationale d’AMP vigilance.
L’AMP vigilance comporte une dimension transversale forte, impliquant souvent d’autres systèmes de vigilance sanitaire, notamment la matériovigilance et la pharmacovigilance. Ceci a justifié le développement de procédures d’échanges des données avec ces systèmes de vigilance sanitaire pilotés par l’ANSM.
Matériel et méthodes
Les incidents et les effets indésirables doivent faire l’objet d’une déclaration par les CLA à l’Agence de la biomédecine au moyen d’une fiche, de préférence par l’application informatique AMP Vigie.
En 2014, 95% des déclarations ont été saisies directement dans AMP Vigie par le CLA du centre d’AMP.
Les incidents et effets indésirables recueillis sont analysés et évalués en termes de gravité et d’imputabilité.
On distingue ainsi 5 niveaux de gravité, de G1 à G5, présentés ci-dessous :
| G1 | Diminution de la performance du processus, sans conséquence sur son résultat, et/ou source de contrainte opérationnelle acceptable |
| G2 | Dégradation de la performance du processus susceptible ou ayant altéré de façon modérée son résultat et/ou source de contrainte opérationnelle non acceptable Perte d’embryons et/ou de gamètes sans disparition des chances de procréation sur la tentative |
| G3 | Dégradation de la performance du processus ayant altéré de façon importante son résultat. Complications liées au processus d’AMP avec hospitalisation et/ou incapacité fonctionnelle mineure Intervention médicale ou chirurgicale afin d’exclure tout dommage permanent ou infirmité corporelle Risque de transmission d’affection(s) à morbidité modérée accessible(s) à un traitement Perte d’embryons et/ou des gamètes avec disparition des chances de procréation sur la tentative |
| G4 | Acte ou procédure sur un patient autre (erreur d’attribution) Perte d’embryons et/ou des gamètes avec disparition définitive des chances de procréation pour le couple Complications sévères liées au processus d’AMP avec hospitalisation supérieure à 7 jours et/ou incapacité fonctionnelle majeure Risque de transmission par les gamètes d’affection(s) à morbidité sévère : affections transmissibles avec mise en jeu du pronostic vital |
| G5 | Décès au cours du processus d’AMP Incapacité fonctionnelle majeure et permanente |
L’imputabilité est une estimation individuelle, pour une déclaration donnée, de la probabilité de la relation existante entre le processus d’AMP et la survenue d’un effet indésirable. L’ensemble des étapes du processus d’AMP et leur environnement doivent être pris en compte. Il peut y avoir une différence entre le niveau d’imputabilité établi lors de la survenue de l’événement indésirable et celui retenu après investigation du cas. Il s’agit donc d’une estimation initiale qui est réévaluée et modifiée si besoin par le CLA dans la partie B de la fiche de déclaration. Après réception de chaque déclaration, l’Agence de la biomédecine réévalue son niveau d’imputabilité pour s’assurer d’une utilisation cohérente de l’échelle ou attribue une imputabilité à cet événement si cela n’a pas déjà été fait par le déclarant.
Résultats
Données générales
En 2014, l’Agence de la biomédecine a reçu un total de 558 déclarations d’AMP vigilance2. Parmi celles-ci, 548 provenaient de 89 centres d’AMP (85 centres clinico-biologiques et 4 laboratoires d’insémination artificielle), ce qui représente en moyenne 6,1 déclarations ± 6,3 par centre [1-40].
Les 10 autres déclarations provenaient du système d’alerte européen « RATC » et concernaient essentiellement la découverte de maladies génétiques chez des enfants nés à l’étranger de femme ayant eu recours à un don de sperme provenant d’une banque étrangère. Ces signalements sont transmis à l’ABM dès lors qu’une ou plusieurs femmes françaises sont concernées par l’utilisation des paillettes de sperme du donneur incriminé.
Ces 558 déclarations sont réparties en 423 effets indésirables et en 136 incidents, ce qui correspond à 559 événements indésirables car une déclaration concernait à la fois un incident et un effet indésirable liés.
Parmi ces déclarations, 26% ont fait l’objet d’une déclaration à au moins une autre vigilance. Ce qui reflète bien la dimension transversale importante de l’AMP vigilance et la nécessité d’une coordination avec les autres systèmes de vigilance que ce soit au niveau de l’établissement ou au niveau national.
Nombre de déclaration
L’évolution du nombre de déclarations d'AMP vigilance et du nombre de centres déclarants est présentée à la figure AMPV1.
Figure AMPV1. Evolution du nombre de déclarations d’AMP vigilance et du nombre de centres déclarants de 2010 à 2014
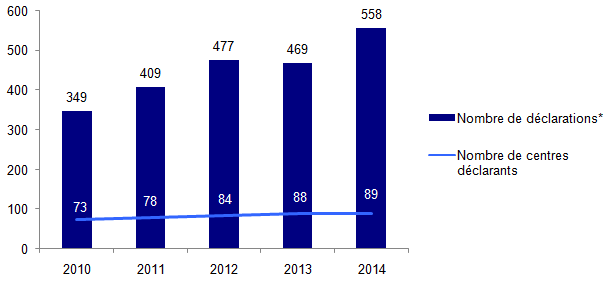
* Déclarations d’événements indésirables adressées à l’Agence de la biomédecine (quelle que soit l’année de constat)
L’analyse du nombre de déclarations par année permet d’évaluer l’efficacité du dispositif mis en place.
Le nombre de déclarations a pratiquement triplé depuis la mise en place du dispositif en 2008. Entre 2013 et 2014, on observe une augmentation de 19% du nombre de déclarations.
Depuis 2009, tous les centres clinico-biologiques d’AMP ont fait au moins une déclaration en AMP vigilance.
Délai de déclaration
Le décret de juin 2008 prévoit que les CLA déclarent les incidents et les effets indésirables sans délai à l’Agence de la biomédecine ce qui, en pratique, se traduit par un délai de déclaration ne devant pas excéder 48 heures pour les événements graves.
Le délai moyen entre la déclaration faite à l’Agence de la biomédecine en 2014 et la date de constatation de l’événement indésirable est bien supérieur avec une moyenne de 68 jours et une médiane à 41 jours. Il existe une grande variabilité de ce délai attestée par la valeur de l’écart-type à 79 jours et des valeurs extrêmes comprises entre 0 et 656 jours soit près de 2 ans.
La répartition et l’évolution du délai de déclaration depuis 2010 est présentée dans le tableau AMPV1.
Tableau AMPV1. Répartition des événements indésirables selon le délai de déclaration
Année de la déclaration |
Délai* |
Total |
|||
<= 1 mois** |
] 1 mois - 6 mois] |
] 6 mois - 12 mois] |
>= 12 mois |
||
2010 |
36,4% (n=127) |
51,0% (n=178) |
11,5% (n=40) |
1,1% (n=4) |
100,0% |
2011 |
36,4% (n=149) |
49,1% (n=201) |
13,4% (n=55) |
1,0% (n=4) |
100,0% |
2012 |
36,5% (n=174) |
49,9% (n=238) |
10,7% (n=51) |
2,9% (n=14) |
100,0% |
2013 |
45,4% (n=213) |
46,9% (n=220) |
6,8% (n=32) |
0,9% (n=4) |
100,0% |
2014 |
44,4% (n=248) |
46,9% (n=262) |
7,7% (n=43) |
1,1% (n=6) |
100,0% |
* Délai en jours mesuré entre la date à laquelle l'événement indésirable est constaté et la date de la déclaration de cet événement à l'Agence de la biomédecine
** 31 jours
En 2014, presque la moitié des déclarations ont été envoyées dans le mois qui suit la constatation de l’événement indésirable. Environ 9% des événements ont été déclarés plus de 6 mois après la constatation de l’événement. Entre 2010 et 2014, on observe une diminution du délai de déclaration puisque près de 44% (versus 36%) des déclarations sont envoyées dans le mois suivant le constat de l’événement.
Afin de favoriser une meilleure réactivité pour l’envoi de la fiche initiale de déclaration, une réflexion est en cours afin de simplifier la partie A de la fiche qui contiendra essentiellement des données factuelles et descriptives de l’événement constaté. Le résultat des investigations et le descriptif des mesures correctives ou préventives éventuelles seront renseignés secondairement dans la partie B.
Effets indésirables
Parmi les 558 déclarations d’événements indésirables, l’Agence de la biomédecine a reçu 423 effets indésirables dont 92% étaient des effets graves (n=391), c’est-à-dire susceptibles d’entraîner la mort ou de mettre la vie en danger, d’entraîner une invalidité ou une incapacité, de provoquer ou de prolonger une hospitalisation ou tout autre état morbide ou susceptibles de se reproduire chez un ou plusieurs donneurs ou personnes qui ont recours à l’AMP.
Taux de notification des effets indésirables par classe d’activité
L’évolution du nombre de déclarations d’effets indésirables selon les classes d’activité (AMP, Autoconservation, Dons) est présentée dans le tableau AMPV2.
Tableau AMPV2. Nombre de déclarations d’effets indésirables selon les classes d’activité (AMP, Autoconservation, Dons)
Activité |
2012 |
2013 |
2014 |
||
Nombre d'actes d'AMP(a) |
Nombre d'effets indésirables |
Nombre d'actes d'AMP(a) * |
Nombre d'effets indésirables |
Nombre d'effets indésirables |
|
AMP |
142 618 |
386 |
141 147 |
364 |
422 |
Inséminations |
58 478 |
5 |
56 393 |
4 |
6 |
Fécondations (FIV, ICSI) |
62 060 |
351 |
61 297 |
337 |
386 |
TEC |
22 080 |
6 |
22 829 |
3 |
5 |
DPI |
557 |
6 |
628 |
8 |
6 |
Type d'AMP non renseigné |
|
18 |
|
12 |
19 |
Autoconservations |
9 867 |
0 |
9 875 |
0 |
1 |
Préservation de la fertilité (b) |
4 091 |
. |
4 190 |
. |
. |
En cours d'AMP (c) |
5 776 |
. |
5 685 |
. |
. |
Dons (gestion des donneurs) |
664 |
4 |
687 |
1 |
2 |
Donneurs de spermes |
244 |
0 |
268 |
1 |
0 |
Donneuses d'ovocytes |
420 |
4 |
419 |
0 |
2 |
* il manque les données d’un centre
- (a) Tentatives : cycles d'insémination artificielle (IIU, IIC) ; ponctions d'ovocytes dans le cadre des fécondations in vitro (FIV, ICSI) ; transferts d'embryons congelés (TEC)
- (b) Il s’agit des nouvelles autoconservations de spermatozoïdes réalisées dans l’année (en nombre de patients)
- (c) Il s’agit des nouvelles autoconservations de l’année (en nombre de patients). Les autoconservations concernent les tissus germinaux quel qu’il soit (spermatozoïdes, ovocytes, tissus testiculaires et ovariens
En AMP, en moyenne, au niveau national, si on rapporte le nombre d’effets indésirables déclarés à l’activité, on obtient un indicateur de 2,7 effets indésirables déclarés pour 1000 actes d’AMP en 2012 (rapporté à l’activité 2012), de 2,6‰ en 2013 (rapporté à l’activité de 2013) et de 3‰ en 2014 (rapporté à l’activité de 2013). Ce nombre d’actes inclut les actes d’inséminations pour lesquels il y a très peu d’effets indésirables déclarés, ce qui peut de façon artéfactuelle sous-estimer les taux.
La légère augmentation de cet indicateur en 2014 traduit probablement une adhésion plus importante de l’ensemble des professionnels au système de déclaration.
Répartition des effets indésirables selon la typologie
La distribution des effets indésirables selon la typologie en 2014 est présentée à la figure AMPV2.
Figure AMPV2. Répartition des types d’effets indésirables (n=423)
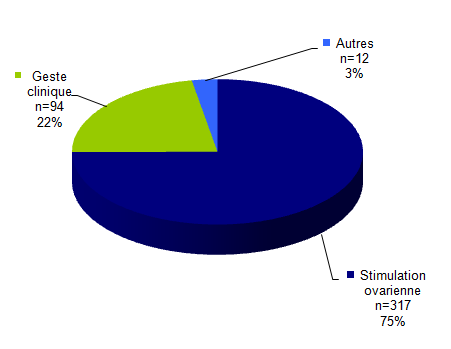
Pour l’année 2014, parmi les 423 effets indésirables déclarés : 317 (75%) concernent la stimulation ovarienne, 94 (22%) concernent un geste clinique lors de l’AMP (inséminations, ponctions, transferts), et 12 (3%) sont classés comme « autres ». Ces derniers concernent essentiellement la découverte de maladies génétiques chez des enfants nés à l’étranger de femmes ayant eu recours à un don de sperme provenant d’une banque étrangère (alertes RATC).
- Effets indésirables relatifs à la stimulation ovarienne
La distribution des effets indésirables relatifs à la stimulation ovarienne selon leur gravité est présentée à la figure AMPV3
Figure AMPV3. Répartition des effets indésirables relatifs à la stimulation ovarienne selon leur gravité (n=317)
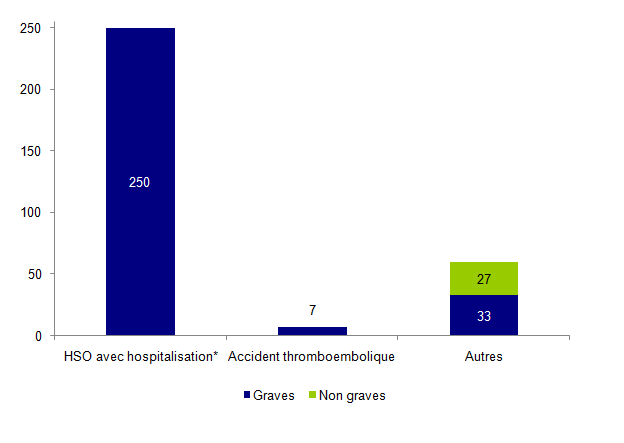
* HSO avec hospitalisation hors accidents thromboemboliques et torsions d’annexes
Soixante-quinze pour cent des effets indésirables rapportés concernent des événements relatifs à la stimulation ovarienne (n = 317). Ces 317 effets indésirables comprennent essentiellement des effets indésirables graves (91%). Il s’agit le plus souvent de syndromes d’hyperstimulation ovarienne sévères avec hospitalisation d’au moins 24 heures (250/317 soit 79%). 7 cas de thromboses ont été rapportés par 6 centres d’AMP chez des femmes âgées en moyenne de 32 ± 5,2 ans [26-39]. Ces 7 cas sont répartis en 1 embolie pulmonaire bilatérale, 1 phlébite profonde des membres inférieurs, 2 thromboses veineuses jugulaires, 1 thrombose de la veine sous-clavière, 2 thromboses de la veine saphène. Dans 3 observations, il est mentionné un syndrome d’hyperstimulation ovarienne sévère associé.
Parmi les 60 événements renseignés comme « Autres », on retrouve 40% de torsions d’annexes (24/60) et 33% d’HSO sans hospitalisation (20/60). Dans 5 observations de torsions d’annexes, il est mentionné un syndrome d’hyperstimulation ovarienne sévère associé.
La part importante des déclarations relatives aux syndromes d’hyperstimulation ovarienne (représentant près de 50% de l’ensemble des déclarations depuis de nombreuses années) a motivé le développement par l’Agence de la biomédecine d’un outil de formation dédié afin que le professionnel de santé puisse mieux les appréhender pour limiter leur survenue et tendre à diminuer la gravité de leurs conséquences. Néanmoins, au vu de leur nombre et de l’importance de leur sous-notification, la discussion reste ouverte pour surveiller ces effets à l’aide d’une méthode reposant sur le suivi en temps réel des activités de stimulation. Celle-ci permettrait à la fois aux centres de s’auto-évaluer mais également de les alerter lors de l’observation de toute dérive tendancielle défavorable.
- Effets indésirables relatifs à un geste clinique
La distribution des effets indésirables relatifs à un geste clinique lors de l’AMP selon leur gravité est présentée à la figure AMPV4.
Figure AMPV4. Répartition des effets indésirables relatifs à un geste clinique selon leur gravité (n=94)
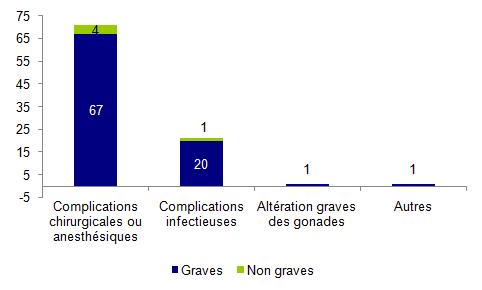
Un effet indésirable concernait une altération grave des gonades, il s’agissait d’une nécrose d'un ovaire suite à une probable torsion ovarienne non dépistée.
L’effet indésirable renseigné comme « Autres » correspondaient à une grossesse extra-utérine.
Gravité / Conséquences
La gestion des déclarations par l’Agence de la biomédecine est notamment basée sur le niveau de gravité des effets indésirables rapportés.
Il existe 5 niveaux de gravité allant de G1 à G5, les niveaux G3 à G5 correspondant à des événements indésirables avec des conséquences graves.
La distribution des effets indésirables en 2014 en fonction de la gravité est présentée dans la figure AMPV5.
Figure AMPV5. Gravité des effets indésirables en 2014
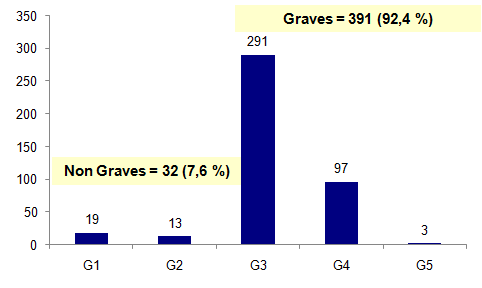
Les effets indésirables graves (gravité G3 et au-delà) représentent la majorité des événements indésirables rapportés. En effet, en 2014, 391 effets indésirables, soit 92% des effets indésirables, ont été cotés comme graves (G3, G4, G5). Cette proportion importante d’effets indésirables graves est directement liée au nombre important d’HSO avec hospitalisation déclarées.
Le type de conséquences pour les 423 effets indésirables observés chez le patient est présenté au tableau AMPV3.
Parmi les 423 déclarations d’effets indésirables, la plupart (372/423 soit 88%) ont entraîné une hospitalisation. Pour 8 déclarations, cette information n’a pas été renseignée.
Tableau AMPV3. Conséquences des effets indésirables chez les couples ou patients concernés
|
Conséquences |
||
|
N |
Incapacité |
Décès |
Hospitalisation et mise en jeu du pronostic vital |
26 |
3 |
1 |
Hospitalisation sans mise en jeu du pronostic vital |
346 |
8 |
0 |
Aucune hospitalisation |
43 |
1 |
0 |
Total (événements chez le patient) |
415 |
12 |
1 |
Parmi ces 372 cas d’hospitalisation, 7% (26/372) ont entrainé la mise en jeu du pronostic vital avec pour conséquences une incapacité/invalidité dans 3 cas et un décès.
Le décès est survenu chez une patiente de 32 ans la veille d’une ponction ovocytaire dans le cadre d’une 3ème FIV ICSI avec protocole long. Un arrêt cardiaque est survenu brutalement. Le rapport d’autopsie a conclu en la présence d’une thrombose récente oblitérante du tronc commun des coronaires compliquée d’un infarctus du myocarde. Les investigations sont en cours avec le CLA afin de rechercher a posteriori des facteurs de risque cliniques ou biologiques chez la patiente et renforcer si besoin, la communication auprès des professionnels sur la gestion des risques cardio-vasculaires.
Parmi les hospitalisations n’ayant pas entrainé de mise en jeu du pronostic vital, 8 cas ont eu pour conséquences une invalidité/incapacité.
Les durées d’hospitalisation en fonction du type d’effet indésirable sont présentées dans le tableau AMPV4.
Tableau AMPV4. Durée d'hospitalisation (jours) selon le type d'effet indésirable
|
|
Durée d’hospitalisation (jours) |
|||||
Typologie |
|
N* |
Moyenne |
Ecart-type |
Médiane |
Minimum |
Maximum |
Evénements relatifs à une stimulation ovarienne |
HSO avec hospitalisation |
236 |
6,5 |
5,6 |
5 |
1 |
37 |
Accident thromboembolique |
4 |
8,5 |
3,8 |
7 |
6 |
14 |
|
Autres |
29 |
4,7 |
6,1 |
3 |
1 |
32 |
|
Evénements relatifs à un geste clinique |
Complications opératoires ou anesthésiques |
56 |
2,9 |
1,6 |
3 |
1 |
8 |
Complications infectieuses |
20 |
7,1 |
5,3 |
5.5 |
1 |
21 |
|
Altération graves des gonades |
1 |
7,0 |
NC |
7 |
7 |
7 |
|
Autres |
1 |
4,0 |
NC |
4 |
4 |
4 |
|
Autres |
Autres |
2 |
17,0 |
18,4 |
17 |
4 |
30 |
Total |
|
349 |
5,9 |
5,5 |
4 |
1 |
37 |
* Nombre d’effets indésirables pour lesquels la durée d’hospitalisation a été renseignée (non renseignée : n=23)
(Parmi les 423 effets indésirables déclarés, 372 ont entrainé une hospitalisation)
NC : non calculable
Parmi les 372 déclarations d’effets indésirables ayant entraîné une hospitalisation, la durée d’hospitalisation a été renseignée pour 349 effets. Pour ces effets, la durée moyenne d’hospitalisation a été d’environ 6 jours avec une médiane à 4 jours. Les durées moyennes d’hospitalisation les plus longues s’observent dans les cas d’accidents thromboemboliques et les complications infectieuses.
Parmi les 250 HSO avec hospitalisation, 11 HSO ont entrainé une hospitalisation d'une journée et 225 une hospitalisation de plus d'une journée. A noter, la durée d’hospitalisation la plus longue a été de 37 jours chez une patiente de 32 ans pour une HSO avec épanchement pleural et ascite.
De façon cumulée, ces effets indésirables rapportés et pour lesquels on dispose de l’information, ont généré un nombre total de 1 534 journées d’hospitalisation.
Imputabilité
La répartition des effets indésirables en fonction de l’imputabilité est présentée à la figure AMPV6.
Figure AMPV6. Répartition des effets indésirables selon le niveau d'imputabilité (n=423)
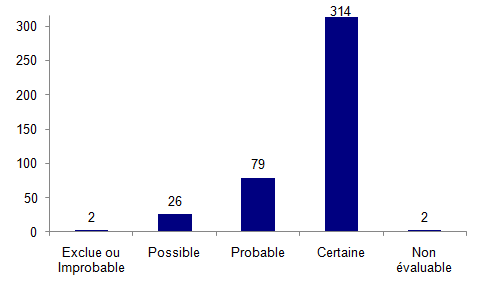
L’imputabilité a été cotée le plus souvent comme certaine (74%) en raison d’un lien fréquent entre l’activité et la survenue de l’effet indésirable.
Deux effets indésirables ont été considérés comme exclus : une poussée d’Herpes simplex de type 1 au niveau vulvaire (ainsi que chez son mari) chez une patiente le jour de la ponction et une endométrite avec sepsis sévère sur grossesse arrêtée à 6 ½ SA.
Les effets indésirables qui ont d’emblée une imputabilité exclue, c’est-à-dire pour lesquels il n’y a pas de lien de causalité entre l’effet indésirable et l’AMP ne devraient pas être déclarés en AMP vigilance.
Actions entreprises par le centre
Globalement, dans 30% des déclarations d’effets indésirables (128/423), au moins une action relative au signalement à une autre vigilance (26%) ou à la mise en place de mesures ou modifications des procédures (4%) a été faite.
Activité de don ou événement donneur
Parmi les 423 effets indésirables, 2 cas graves concernaient des donneuses d’ovocytes :
- un hémopéritoine de moyenne abondance (chute de l’hémoglobine de 13 à 10,4g) ayant nécessité 3 jours d’hospitalisation. Il n’y a pas eu de mise en jeu du pronostic vital
- une hyperstimulation ovarienne de stade 3 chez une donneuse de 32 ans (32 follicules ponctionnés au lieu de 8 attendus) ayant nécessité 3 jours d’hospitalisation. Il n’y a pas eu de mise en jeu du pronostic vital. La procédure relative au déclenchement des donneuses a été modifiée en précisant d’éviter de déclencher par hCG et de préconiser les analogues de la GnRH.
Activité d’autoconservation
Parmi les 423 effets indésirables, 1 cas grave concernait une ponction en vue d’une autoconservation. Il s’agissait d’un hémopéritoine post ponction ovarienne pour maturation in vitro des ovocytes dans le cadre de l'oncofertilité (carcinome canalaire infiltrant du sein). La patiente a été hospitalisée en réanimation pendant 48 heures avec déglobulisation et transfusion de 2 culots.
Incidents
Parmi les 558 déclarations d’événements indésirables, l’Agence a reçu 136 incidents dont 43% étaient des incidents graves (n=59), c’est-à-dire susceptible d’entraîner des effets indésirables graves ou occasionnant une erreur d’attribution ou une perte de gamètes, tissus germinaux ou embryons avec perte de chance totale de procréation sur la tentative ou pour le couple.
Répartition des incidents par étape du processus
Afin d’identifier les étapes du processus les plus à risque d’incidents, la répartition des incidents par étape du processus et par gravité est représentée à la figure AMPV7.
Figure AMPV7. Répartition du nombre d’incidents par étape et par gravité
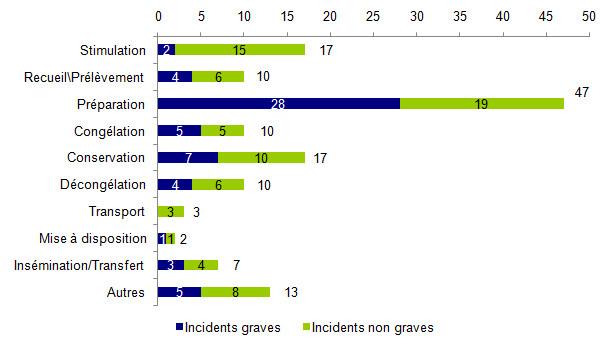
Bien que le nombre de déclarations ne soit pas exhaustif, ce graphe montre que les 3 étapes du processus qui semblent le plus à risque d’incidents sont :
- La préparation et culture des gamètes/embryons (34% des déclarations d’incidents)
- La stimulation ovarienne (12% des déclarations d’incidents)
- La conservation (12% des déclarations d’incidents)
Parmi les incidents survenus lors de la préparation / culture, environ 60% concernaient des incidents graves, c’est-à-dire pour lesquels l’incident a eu pour conséquence une perte totale des gamètes ou embryons sur la tentative.
Inversement, lors de l’étape de stimulation ovarienne et de conservation, il s’agit plus particulièrement d’incidents non graves (respectivement 88% et 59%).
Les étapes qui ont été renseignées comme « Autres » correspondaient notamment à la réception des gamètes, aux accords administratifs (décongélation, transfert d’embryon), à la conservation informatique des données et au bilan biologique pré - AMP.
Répartition des incidents selon la typologie
La répartition des incidents selon leur typologie est représentée dans la figure AMPV8.
Figure AMPV8. Répartition des incidents selon leur typologie (n=136)
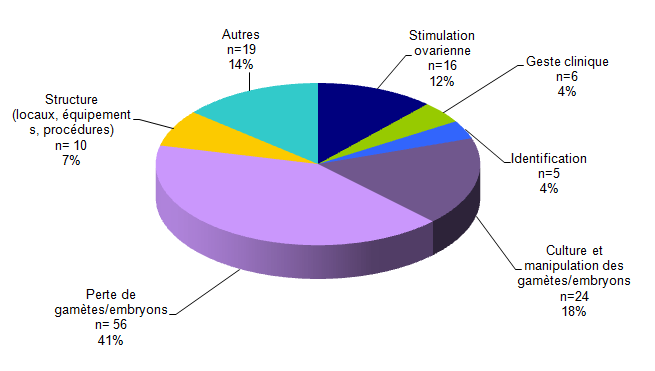
Pour l’année 2014, parmi les 136 incidents déclarés :
- 56 (41%) concernent une perte de gamètes / embryons
- 24 (18%) concernent la culture et la préparation de gamètes / embryons
- 16 (12%) concernent la stimulation ovarienne
- 10 (7%) concernent la structure (locaux, équipements, procédures)
- 6 (4%) concerne le geste clinique (insémination, ponction, transfert d’embryons)
- 5 (4%) concerne l’identification des patients ou des gamètes, embryons ou tissus
- 19 (14%) sont classés comme « Autres ».
Les incidents classés comme « Autres » concernaient notamment des erreurs dans le nombre d’embryons à transférer, une erreur de circuit de prise en charge lors d’une autoconservation en urgence avec découverte a postériori d’une sérologie VHB positive, la constatation le jour de la ponction que les tests de sécurité sanitaires du partenaire dataient de plus d’un an, des accords de décongélation et de transfert d’embryon manquants, une fusion de dossiers dans un logiciel d’AMP, etc.
- Incidents relatifs à la stimulation ovarienne
La distribution des incidents relatifs à la stimulation ovarienne selon leur gravité en 2014 est présentée à la figure AMPV9.
Figure AMPV9. Répartition des incidents relatifs à une stimulation ovarienne selon leur gravité (n=16)
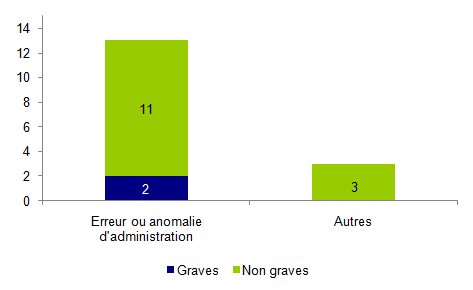
Parmi les 16 incidents déclarés concernant la stimulation ovarienne, plus de 80% (13/16) concernent des erreurs ou anomalies d’administration de traitement (erreur de dose, erreur de jour, erreur de médicament) qui sont pour la plupart des incidents non graves. Les 3 autres incidents concernaient des erreurs dans le dosage de l’œstradiol par le laboratoire et qui ont fait l’objet d’une transmission en réactovigilance.
- Incidents relatifs à la culture et préparation des embryons/gamètes
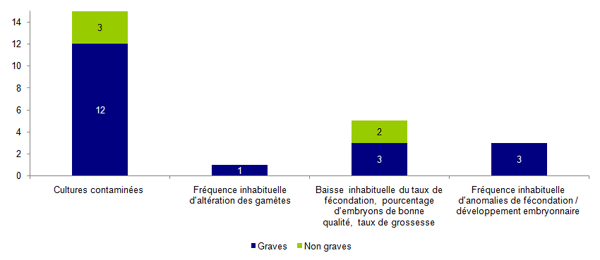
La distribution des incidents relatifs à la culture et préparation des embryons/gamètes selon leur gravité est présentée à la figure AMPV10.
Les incidents lors de la culture et la préparation des gamètes / embryons représentent 18% des déclarations d’incidents et sont majoritairement des incidents graves (79%) car ils ont entrainé une perte totale de gamètes/embryons sur la tentative.
Parmi ces incidents, plus de 60% (15/24) concernent des cultures contaminées qui pour la plupart sont des incidents graves. Environ 30% de ces contaminations étaient d’origine spermatique (5/15), 27% d’origine environnementale (4/15) et 13% d’origine manuportée (2/15). Pour les 4 autres déclarations, la cause de la contamination était non connue. Ces déclarations proviennent de différents centres d’AMP.
Les autres incidents relatifs à la culture (n=9) concernent des fréquences inhabituelles d’altération des gamètes, des baisses anormales des taux de fécondation et de grossesse ou des anomalies de développement embryonnaire. Pour 4 de ces déclarations il a été évoqué une possible cause environnementale : odeurs nauséabondes, odeurs d’hydrocarbures, vibrations dues à un marteau piqueur, utilisation de désodorisants, problèmes de ventilation et de panne de surpression.
Au vu de l’augmentation sensible du nombre de déclarations faisant état d’incidents pouvant être liés à la contamination environnementale des gamètes ou embryons, l’Agence de la biomédecine a adressé en 2014 un questionnaire à l’ensemble des centres clinico-biologiques afin d’évaluer l’environnement de la zone de préparation et réviser, le cas échéant, les exigences réglementaires.
Figure AMPV10. Répartition des incidents relatifs à la culture et préparation des embryons / gamètes selon leur gravité (n=24)
- Incidents relatifs à la perte ou à la destruction de gamètes/embryons
La distribution des incidents relatifs à une perte ou à une destruction de gamètes/embryons est présentée à la figure AMPV11.
Figure AMPV11. Répartition des incidents relatifs à la perte ou la destruction des embryons / gamètes selon leur gravité (n=56)
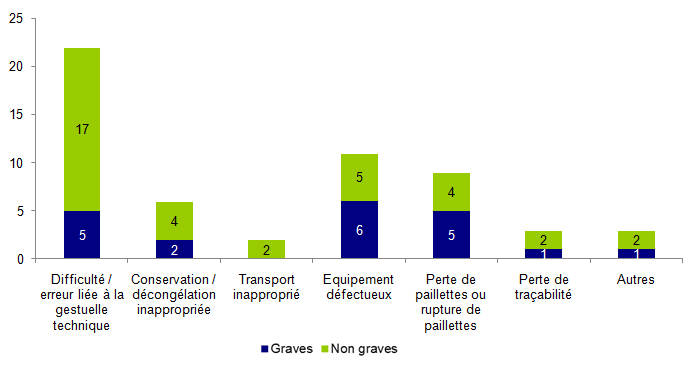
Les événements renseignés comme « Autres » correspondaient à la lyse de 2 embryons à J2 sans cause identifiée, l’apparition de « contaminants » dans le milieu de culture embryonnaire pour une ponction avec piste infectieuse écartée et à un défaut de communication avec le laboratoire concernant l’arrêt d’une procédure de TEC.
- Incidents relatifs à la structure (locaux, équipements, procédures)
La répartition des incidents relatifs à la structure selon leur gravité est présentée à la figure AMPV12.
Figure AMPV12. Répartition des incidents relatifs à la structure selon leur gravité (n=10)
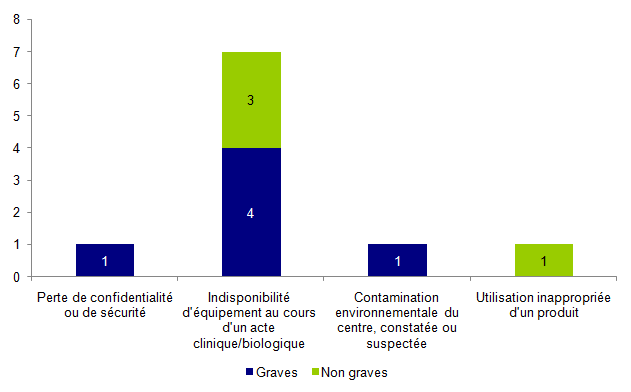
En 2014, 10 incidents relatifs à la structure ont été rapportés. Il s’agit pour plus de la moitié d’incidents graves (60%). La typologie la plus souvent rapportée concerne une indisponibilité d'équipement au cours d'un acte clinique/biologique d'AMP avec perte de chance.
Erreurs d’identification
En 2014, 5 erreurs d’identification ont été déclarées. Parmi ces 5 erreurs :
- 2 ont entrainé une erreur d’attribution de sperme lors d’une insémination artificielle. Il s’agissait dans les 2 cas d’une mauvaise vérification de l’identité au moment de la préparation du cathéter et du geste clinique. Un rappel des bonnes pratiques a été effectué et des procédures supplémentaires de vérification de l’identité ont été mises en place. L’Agence a renvoyé aux centres la fiche pratique RETEX sur les erreurs d’attribution.
- 2 concernaient des erreurs d’insémination de sperme lors de FIV. Dans un cas il s’agissait d’une erreur d’étiquetage du tube de dilution du sperme du couple 1 avec une étiquette prise dans le dossier du couple 2. Dans l’autre cas, il s’agissait d’une négligence du professionnel qui n’a pas pris en compte, dans un premier temps, l’alarme du logiciel Witness de sorte que 3 ovocytes sur 11 ont été inséminés à tort. Pour ces 2 cas, des mesures barrières ont permis d’éviter l’attribution erronée des embryons.
- 1 concernant une erreur d’étiquetage d’un prélèvement de sperme. Le prélèvement a été détruit.
Ces erreurs d’attribution dont certaines ont pu (ou auraient pu) aboutir à l’insémination de sperme ou au transfert d’embryons ne correspondant pas aux caractéristiques du couple font parties des événements à impact fort justifiant, au-delà des mesures correctives prises localement, une réflexion au sein de l’Agence de la biomédecine sur le renforcement des mesures barrières. Celles-ci pourraient se traduire par une révision des bonnes pratiques en ce sens.
Gravité / Conséquences
Tout comme pour les effets indésirables, la gestion des déclarations d’incidents par l’Agence de la biomédecine est notamment basée sur le niveau de gravité des conséquences des événements rapportés. Pour les incidents, seul le caractère grave ou non grave a été pris en compte.
La distribution des incidents en fonction de la gravité est présentée dans la figure AMPV13.
Figure AMPV13. Gravité des incidents en 2014
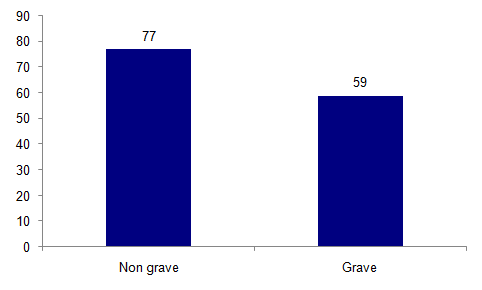
Les incidents non graves représentant un peu plus de la moitié des incidents rapportés. En effet, en 2014, 77 incidents, soit 57% des incidents, ont été cotés comme non graves et 43% comme graves.
On observe, en 2014, une augmentation des déclarations d’incidents graves par rapport aux années précédentes tout en restant à peu près stable au cours du temps quant à la proportion qu’ils représentent par rapport à l’ensemble des incidents (excepté en 2013).
En 2014 :
- parmi les 41 incidents déclarés concernant les gamètes, 28 ont entraîné une perte de gamètes ;
- parmi les 68 incidents déclarés concernant les embryons, 49 ont entraîné une perte d’embryons ;
- un incident a été déclaré concernant les tissus germinaux mais il n’a pas entrainé de perte de tissus.
Ces 77 incidents avec perte de gamètes ou d’embryons ont eu pour conséquences :
- une perte de chance de procréation totale sur la tentative pour 60 couples ou patients ;
- une perte de chance de procréation partielle sur la tentative pour 43 couples ou patients ;
- une perte de chance de procréation potentielle pour 71 couples ou patients.
Actions entreprises par le centre
Globalement, dans 74% des déclarations d’incidents (101/136), au moins une action relative au signalement à une autre vigilance (18%) ou à la mise en place de mesures préventives ou correctives (56%) a été faite.
Les mesures préventives ou correctives concernaient essentiellement la mise en place ou la modification des procédures (58%), la réparation ou le remplacement du matériel défectueux (16%) voire d’autres types de mesures préventives (26%) telles que le rappel des bonnes pratiques dans la majorité des cas.
Pour 48% des incidents (66/136), le centre d’AMP a estimé qu’ils étaient évitables. Il faut noter que pour 43% (58/136) des déclarations, cet item n’a pas été renseigné ou a été renseigné « Ne sait pas ».
Activité de don
Parmi les 136 incidents, 3 concernaient le don de gamètes. Il s’agissait :
- d’un défaut de fonctionnement des sondes de détection de température des cuves dédiées aux spermatozoïdes de donneurs;
- de la fusion de dossiers dans le logiciel d’AMP
- de la découverte d’une alpha thalassémie chez un donneur d’une banque de sperme étrangère transmise à l’Agence de la biomédecine via le système d’alertes européennes « RATC ». Concernant cette déclaration, il s’agit davantage d’une information post-don (IPD) que d’un réel incident. Outre son intérêt de santé publique, la déclaration des IPD intervient dans la protection du donneur comme du receveur. Toutefois, l’obligation de déclaration des informations post-don n’est pas encore réglementée et, à défaut de pouvoir les enregistrer spécifiquement dans l’outil AMP vigie, ces événements sont comptabilisés parmi les « incidents » bien qu’ils ne répondent pas stricto sensu à leur définition. Par ailleurs, il n’a pas été possible d’apprécier les mesures mises en œuvre pour la patientèle française en raison des difficultés pour obtenir des informations exploitables de la part de la banque étrangère.
Activité d’autoconservation
Parmi les 14 déclarations d’incidents qui concernent l’autoconservation, 4 sont relatives à une autoconservation en vue de préservation de la fertilité et 10 à une autoconservation dans le cadre de l’AMP.
Ces 14 incidents concernent principalement des pertes de gamètes/embryons (43%) (difficulté ou erreur liée à la gestuelle technique, transport inapproprié, perte / rupture de paillette). Les autres incidents ont été renseignés comme « Autres » (ex : perte du registre de conservation, dysfonctionnement des cuves des cryobanques, dysfonctionnement des relances pour la conservation d’embryons, …).
Ces 14 incidents sont répartis en 4 incidents graves et 10 non graves.
Répartition des déclarations par région
La répartition des événements indésirables en fonction de l’activité et des régions est représentée dans le tableau AMPV5.
Tableau AMPV5. Répartition régionale des événements indésirables par activité
|
AMP |
Don |
Autoconservation |
|||
Région |
Nombre d'événements |
Fréquence des événements graves |
Nombre d'événements |
Fréquence des événements graves |
Nombre d'événements |
Fréquence des événements graves |
Guadeloupe |
1 |
100,0% |
. |
. |
. |
. |
La Réunion |
10 |
70,0% |
. |
. |
. |
. |
Ile-de-France |
110 |
63,6% |
2 |
100,0% |
7 |
57,1% |
Champagne-Ardenne |
13 |
92,3% |
. |
. |
. |
. |
Picardie |
18 |
83,3% |
. |
. |
1 |
0,0% |
Haute-Normandie |
27 |
92,6% |
. |
. |
. |
. |
Centre |
17 |
82,4% |
. |
. |
. |
. |
Basse-Normandie |
11 |
72,7% |
. |
. |
1 |
0,0% |
Bourgogne |
40 |
77,5% |
. |
. |
. |
. |
Nord - Pas-de-Calais |
16 |
93,8% |
. |
. |
. |
. |
Lorraine |
8 |
100,0% |
. |
. |
1 |
0,0% |
Alsace |
17 |
100,0% |
1 |
100,0% |
. |
. |
Franche-Comté |
10 |
90,0% |
1 |
0,0% |
2 |
0,0% |
Pays de la Loire |
43 |
79,1% |
. |
. |
1 |
0,0% |
Bretagne |
12 |
83,3% |
1 |
100,0% |
. |
. |
Aquitaine |
26 |
88,5% |
. |
. |
. |
. |
Midi-Pyrénées |
22 |
86,4% |
. |
. |
. |
. |
Limousin |
7 |
100,0% |
. |
. |
. |
. |
Rhône-Alpes |
35 |
85,7% |
. |
. |
. |
. |
Auvergne |
1 |
100,0% |
. |
. |
. |
. |
Languedoc-Roussillon |
39 |
82,1% |
. |
. |
1 |
100,0% |
Provence-Alpes-Côte d'Azur |
48 |
93,8% |
. |
. |
1 |
0,0% |
En 2014, 89 centres d’AMP (centres clinico-biologiques d’AMP ou laboratoires d’IA) répartis dans 22 régions ont fait au moins une déclaration d’AMP vigilance. Dans 3 régions (Corse, Martinique, Poitou-Charentes), les centres d’AMP n’ont fait aucune déclaration d’AMP vigilance. Dans les autres régions, en moyenne près de 25 déclarations d’AMP vigilance ont été faites par région avec des extrêmes allant de 1 déclaration à 110 déclarations.
De manière globale, 85 des 103 centres clinico-biologiques (83%) ont fait au moins une déclaration d’AMP vigilance en 2014. Pour 14 régions, la totalité des centres clinico-biologiques de la région ont fait au moins une déclaration d’AMP vigilance 2014.
Quatre des 97 laboratoires d’insémination artificielle (4%) ont fait au moins une déclaration d’AMP vigilance en 2014 : un en Champagne-Ardenne pour 3 laboratoires actifs, un en île de France pour 16 laboratoires actifs, un en Midi-Pyrénées sur 5 laboratoires actifs, et un en Rhône-Alpes pour 7 laboratoires actifs.
Pour plus d’informations, le rapport annuel d’AMP vigilance 2014 adressé au ministre en charge de la santé est téléchargeable à partir de juillet 2015 sur le site de l’Agence de la biomédecine (http://www.agence-biomedecine.fr/professionnels/amp-vigilance.html)
1 Décret n°2008-588 du 19 juin 2008 transposant en matière de don de gamètes et d’assistance médicale à la procréation la directive 2004/23/CE du Parlement européen et du Conseil du 31 mars 2004
2 La date de déclaration correspond à l’envoi de la Partie A de la fiche de déclaration (déclaration immédiate)