L’AMP vigilance a pour objet la surveillance des incidents relatifs aux gamètes, aux tissus germinaux et aux embryons utilisés à des fins d’assistance médicale à la procréation ou à des fins de préservation de la fertilité, ainsi que des effets indésirables observés chez les donneurs de gamètes ou chez les personnes qui ont recours à l’assistance médicale à la procréation.
On entend par incident tout accident ou erreur survenant au cours des différentes étapes du processus d’AMP, susceptible d’entraîner un effet indésirable sur la personne ou la perte de gamètes, de tissus germinaux ou d’embryons. À titre d’exemple, des incidents à type de perte partielle ou totale d’embryons liée à un matériel défectueux (ex : panne de congélateur) ou de problèmes d’étiquetage des tubes de liquide folliculaire ont été rapportés.
On entend par effet indésirable toute réaction nocive survenant chez une personne liée ou susceptible d’être liée aux activités d’AMP au cours de ses différentes étapes (stimulation, ponction folliculaire, insémination,
transfert embryonnaire). À titre d’exemple, des effets indésirables à type d’hyperstimulations ovariennes sévères, d’hémopéritoine, et d’accidents thromboemboliques ont été rapportés.
L’AMP vigilance est une vigilance sanitaire réglementée confiée à l’Agence de la biomédecine par la loi n°2004-800 du 6 août 2004 relative à la bioéthique. Le décret de juin 20081 a complété l’organisation du dispositif et précisé les rôles des différents acteurs. La loi n°2011-814 du 7 juillet 2011 relative à la bioéthique n’a pas introduit de modifications dans ce champ.
Chaque centre autorisé pour les activités d’AMP doit désigner un correspondant local d’AMP vigilance (CLA). Ce dernier a pour missions de recueillir tous les incidents et les effets indésirables, de les déclarer sans délai à l’Agence de la biomédecine, d’informer les autres correspondants locaux d’AMP vigilance si nécessaire et les autres vigilances sanitaires concernées de son établissement, de participer aux investigations, d’aviser l’Agence de la biomédecine des résultats des investigations et en cas de difficultés de fonctionnement du dispositif. Tout autre professionnel qui ne dépend pas d’un centre d’AMP et qui a connaissance de la survenue d’un événement indésirable doit en informer sans délai l’Agence de la biomédecine. En pratique, il est préférable que ce professionnel de santé en informe le centre d’AMP dans lequel le couple a été pris en charge initialement et que le CLA fasse la déclaration de l’événement indésirable.
Fin 2012, le réseau d’AMP vigilance comprend 193 correspondants locaux d’AMP vigilance désignés dans 99% des 195 centres d’AMP répartis en centres clinico-biologiques et en laboratoires pratiquant uniquement l’insémination artificielle.
Les déclarations d’AMP vigilance sont évaluées et expertisées par l’Agence de la biomédecine en lien avec un groupe de travail externe “AMP vigilance” composé d’experts biologistes et gynécologues-obstétriciens spécialisés dans le domaine de l’AMP. L’Agence de la biomédecine a la possibilité de proposer ou de mettre en œuvre des mesures préventives et/ou correctives dans un but de réduction des risques et d’amélioration des pratiques. L’Agence de la biomédecine assure le secrétariat de la commission nationale d’AMP vigilance.
L’AMP vigilance comporte une dimension transversale forte, impliquant souvent d’autres systèmes de vigilance sanitaire, notamment la matériovigilance, la pharmacovigilance. Ceci a justifié le développement de procédures d’échanges des données avec ces systèmes de vigilance sanitaires pilotés par l’ANSM.
Les correspondants locaux d’AMP vigilance, de par leurs missions déclarent les incidents et/ou effets indésirables à l’Agence de la biomédecine au moyen de la fiche de déclaration.
Ces fiches sont envoyées par fax, mail, courrier ou directement saisies dans l’application sécurisée AMP Vigie, via un portail sécurisé qui permet aux correspondants locaux d’AMP vigilance de déclarer en ligne les incidents et effets indésirables en AMP. En 2012, 85% des déclarations ont été saisies directement en ligne par le CLA du centre d’AMP.
Les événements indésirables recueillis sont analysés et évalués en termes de gravité et d’imputabilité :
On distingue ainsi 5 niveaux de gravité, de G1 à G5, présentés ci-dessous :
|
G1 |
Diminution de la performance du processus, sans conséquence sur son résultat, et/ou source de contrainte opérationnelle acceptable |
|
G2 |
Dégradation de la performance du processus susceptible ou ayant altéré de façon modérée son résultat et/ou source de contrainte opérationnelle non acceptable |
|
G3 |
Dégradation de la performance du processus ayant altéré de façon importante son résultat. |
|
G4 |
Acte ou procédure sur un patient autre (erreur d’attribution) |
|
G5 |
Décès au cours du processus d’AMP |
L’imputabilité consiste en l’analyse de la relation causale entre la survenue d’un événement indésirable observé et un autre événement survenu en amont susceptible d’en être la cause. Il s’agit d’une estimation individuelle pour une déclaration donnée de la probabilité de la relation existante entre le processus d’AMP et la survenue d’un incident ou d’un effet indésirable. L’ensemble des étapes du processus d’AMP et leur environnement doivent être pris en compte. Il peut y avoir une différence entre le niveau d’imputabilité établi lors de la survenue de l’événement indésirable et celui retenu après investigation du cas. Il s’agit donc d’une estimation initiale qui est réévaluée et modifiée si besoin par le CLA dans la partie B de la fiche de déclaration. Après réception de chaque déclaration, l’Agence de la biomédecine réévalue son niveau d’imputabilité pour s’assurer d’une utilisation cohérente de l’échelle ou attribue une imputabilité à cet événement si cela n’a pas déjà été fait par le déclarant.
Entre le 1er janvier et le 31 décembre 2012, l’Agence de la biomédecine a reçu 477 déclarations d’AMP vigilance provenant de 84 centres d’AMP comprenant 82 centres clinico-biologiques et 2 laboratoires d’insémination artificielle.
Le nombre de déclarations a augmenté de façon importante entre 2009 et 2012, témoignant de la montée en charge du dispositif (cf. fig.AMPV1). On observe que le nombre de déclarations a été multiplié par un facteur 2 en 3 ans. Cette augmentation apparente des déclarations témoigne d’une appropriation progressive du dispositif par les professionnels de l’AMP et d’un développement de la culture du signalement chez les professionnels.
En complément de la date de déclaration à l’Agence de la biomédecine, le nombre de signalements en fonction de la date de constatation de l’événement indésirable a été calculé depuis l’année 2009.
Figure AMPV1. Évolution du nombre de déclarations d'AMP vigilance depuis 2009
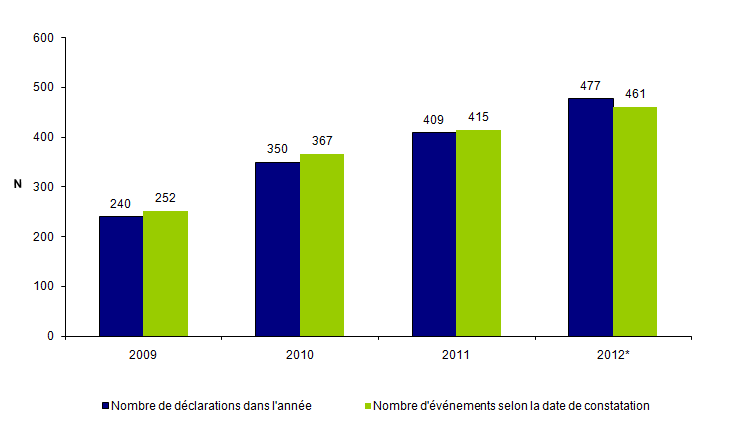
* Données disponibles jusqu’à fin mars 2013 pour le nombre d'événements en fonction de la date de constatation - Nombre d'événements en 2012 : 442 selon les données recueillies jusqu'à fin mars 2013. Nombre d'événements en 2012 estimé par projection : 461.
Délais de déclaration
Le décret de juin 2008 prévoit que les CLAs déclarent les incidents et les effets indésirables sans délai à l’Agence de la biomédecine.
En 2012, le délai moyen entre la date de constatation de l’événement indésirable et la déclaration (Partie A) à l’Agence de la biomédecine a été de 86 jours soit près de 3 mois avec une médiane à 48 jours. Il existe une grande variabilité de ce délai attestée par la valeur de l’écart-type à 107 jours et les valeurs extrêmes comprises entre 0 jour et 798 jours soit un délai de plus de 2 ans pour déclarer un événement indésirable à l’Agence de la biomédecine après sa constatation. Le délai médian de déclaration des événements voisin de 45 jours n’a pas varié depuis 2010. Les délais de déclaration ont aussi été calculés en fonction de la gravité des événements indésirables.
Le signalement pour lequel la déclaration a été faite après plus de 2 ans correspond à un syndrome d’hyperstimulation ovarienne sévère qui ne comporte pas d’information particulière permettant d’expliquer ce délai très long. Toutefois, pour d’autres déclarations, il apparaît que les centres ont déclaré l’événement indésirable après avoir finalisé l’investigation. Cela peut expliquer que le délai de déclaration soit plus long pour des événements plus graves et plus complexes à documenter.
En comparaison aux 3 années précédentes, on n’observe pas d’amélioration en termes de délais de déclaration quel que soit le niveau de gravité des événements (Cf. tab.AMPV1).
Tableau AMPV1. Délais de déclaration des événements en jours à l’Agence de la biomédecine en fonction de la gravité de 2009 à 2012
Année |
|
G1 à G5 |
G1 |
G2 |
G3 |
G4 |
G5 |
2009 |
|||||||
|
N |
213 |
5 |
42 |
136 |
30 |
0 |
|
Moyenne±écart-type |
51 ± 60 |
32 ± 23 |
35 ± 40 |
49 ± 46 |
89 ± 111 |
|
|
médiane |
32 |
31 |
22 |
33 |
44 |
|
|
extrêmes |
[0-501] |
[0-64] |
[1-203] |
[0-209] |
[9-501] |
|
2010 |
|||||||
|
N |
349 |
21 |
54 |
203 |
71 |
0 |
|
Moyenne±écart-type |
77 ± 83 |
91 ± 117 |
72 ± 92 |
76 ± 78 |
78 ± 79 |
|
|
médiane |
46 |
24 |
34 |
48 |
55 |
|
|
extrêmes |
[0-595] |
[0-434] |
[0-373] |
[0-595] |
[0-319] |
|
2011 |
|||||||
|
N |
409 |
11 |
56 |
245 |
96 |
1 |
|
Moyenne±écart-type |
82 ± 87 |
48 ± 45 |
78 ± 99 |
82 ± 86 |
83 ± 80 |
415±NC |
|
médiane |
47 |
35 |
31 |
50 |
50 |
415 |
|
extrêmes |
[0-487] |
[0-120] |
[0-363] |
[0-487] |
[0-353] |
[415-415] |
2012 |
|||||||
|
N |
477 |
27 |
48 |
282 |
119 |
1 |
|
Moyenne±écart-type |
86 ± 107 |
35 ± 53 |
49 ± 45 |
94 ± 115 |
90 ± 107 |
468±NC |
|
médiane |
48 |
12 |
34 |
50 |
55 |
468 |
|
extrêmes |
[0-798] |
[0-241] |
[0-184] |
[0-601] |
[0-798] |
[468-468] |
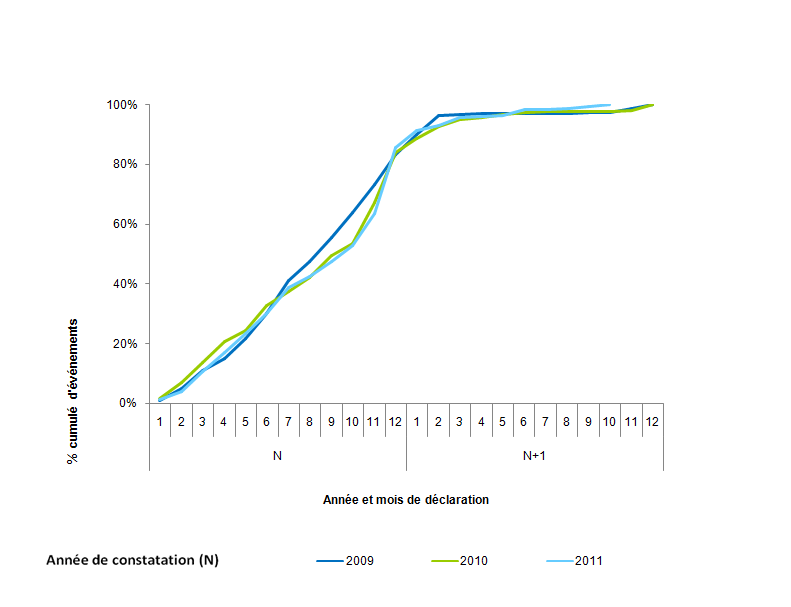
La répartition du nombre cumulé d’événements survenus de 2009 à 2012 selon la date de déclaration a également été analysée (cf. fig.AMPV2). On observe qu’on a recueilli en données cumulées à la fin de l’année civile en moyenne plus de 90 % de la totalité des événements indésirables survenus dans l’année, que la courbe est en plateau en début d’année n+1 avec environ 96 % des événements déclarés au mois de mars.
Figure AMPV2. Répartition du nombre cumulé d'événements survenus de 2009 à 2012 selon la date de déclaration en mois
Distribution des déclarations d’AMP vigilance par région administrative
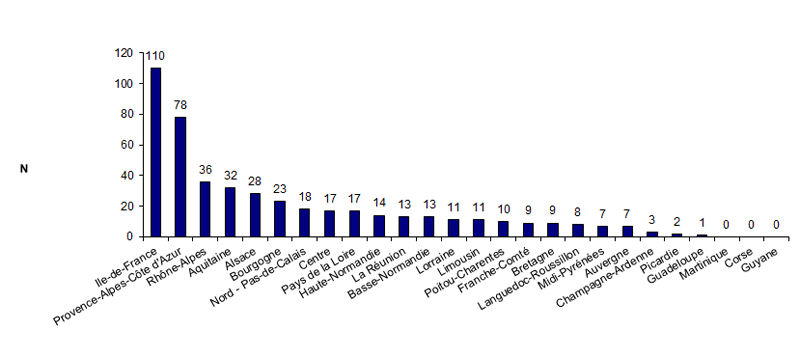
En 2012, 84 centres d’AMP répartis dans 23 régions ont fait au moins une déclaration d’AMP vigilance. Dans 3 régions (Martinique, Corse et Guyane), les centres d’AMP n’ont fait aucune déclaration d’AMP vigilance. Dans les autres régions, en moyenne près de 21 déclarations d’AMP vigilance ont été faites par région avec des extrêmes allant de 1 déclaration à 110 déclarations (cf.fig. AMPV3). Il s’agit de données brutes de déclarations non rapportées à l’activité.
Figure AMPV3. Nombre de déclarations d'AMP vigilance en fonction des régions (n = 477, 2012)
Distribution des incidents et des effets indésirables en fonction de la gravité
La gestion des déclarations par l’Agence de la biomédecine est notamment basée sur le niveau de gravité des conséquences des événements indésirables rapportés.
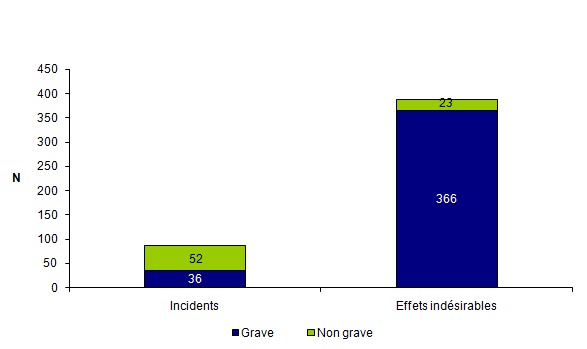
En 2012, les 477 déclarations d’AMP vigilance sont réparties en 389 effets indésirables et en 88 incidents. La proportion d’événements graves (G3, G4, G5) est de 84 %, comparable aux années précédentes. On remarque que la plupart des effets indésirables (94 %) sont cotés comme graves alors que la plupart des incidents (59 %) sont cotés comme non graves (cf fig.AMPV4 et tab.AMPV2).
Tableau AMPV2. Nombre d'incidents et d'effets indésirables en fonction de la gravité (n = 477, 2012)
Niveau de gravité |
Total |
Non graves |
Graves |
||||||||
G1 |
G2 |
G3 |
G4 |
G5 |
|||||||
n |
n |
% |
n |
% |
n |
% |
n |
% |
n |
% |
|
Incidents |
88 |
16 |
18,2 |
36 |
40,9 |
30 |
34,1 |
6 |
6,8 |
0 |
0,0 |
Effets indésirables |
389 |
11 |
2,8 |
12 |
3,1 |
252 |
64,8 |
113 |
29,1 |
1 |
0,3 |
Total |
477 |
27 |
5,7 |
48 |
10,1 |
282 |
59,1 |
119 |
24,9 |
1 |
0,2 |
Figure AMPV4. Nombre d'incidents et d'effets indésirables en fonction de la gravité (n = 477, 2012)
Distribution des incidents et des effets indésirables en fonction de la typologie et de la gravité
Pour l’année 2012, 292 (61 %) événements indésirables concernent la stimulation ovarienne, 101 (21 %) concernent un geste clinique lors de l’AMP (inséminations, ponctions, transferts), 39 (8 %) concernent la perte de gamètes/embryons, 16 (3 %) sont relatifs à la structure, 7 (1,5 %) concernent l’identification / attribution des gamètes ou des embryons, 5 (1 %) concernent la culture des gamètes/embryons, 2 (0,4 %) sont relatifs à une morbidité ou à un décès, et 15 (3 %) sont classés comme autres.
Afin de faciliter la lecture du graphique, les 29 événements indésirables concernant l’identification / attribution des gamètes ou des embryons, la culture des gamètes/embryons, relatifs à une morbidité ou à un décès, et ceux intitulés « autres » selon la typologie de la fiche, ont été regroupés dans la rubrique « divers », compte-tenu de leur fréquence (cf. fig.AMPV5).
Figure AMPV5. Distribution des événements indésirables en fonction de la typologie (n = 477, 2012)
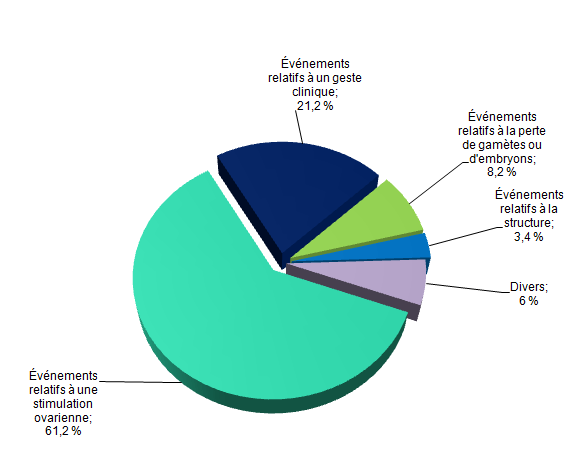
Événements indésirables relatifs à la stimulation ovarienne
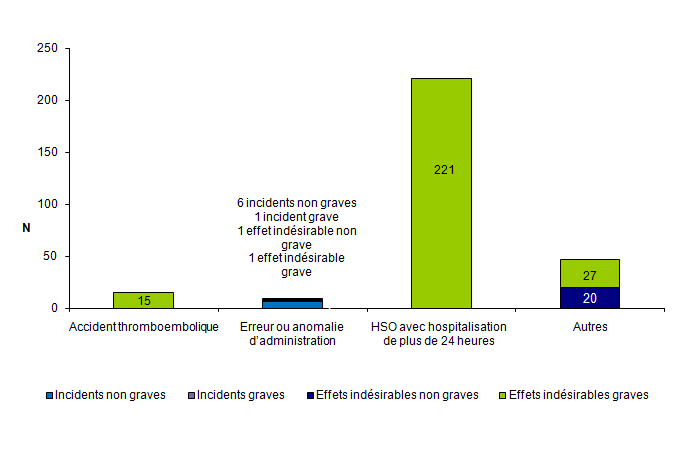
Plus de 61 % des événements indésirables rapportés concernent des événements relatifs à la stimulation ovarienne (n = 292) (cf. fig.AMPV6). Ces 292 événements indésirables comprennent essentiellement des effets indésirables graves (91 %).
Il s’agit le plus souvent de syndromes d’hyperstimulation ovarienne sévères avec hospitalisation de plus de 24 heures (221/292 soit 76 %). Quinze cas de thromboses ont été rapportés par 12 centres d’AMP chez des femmes âgées en moyenne de 33 ± 5 ans [27-45].
Il s’agit de 7 cas de thromboses jugulaires, de 3 cas de phlébites profondes du membre inférieur, de 2 cas d’embolie pulmonaire dont 1 forme bilatérale massive, d’1 cas d’accident vasculaire cérébral avec hémiplégie et séquelles, d’1 cas d’accident ischémique transitoire à type de myodésopsie bilatérale, et d’1 cas de thrombose du membre supérieur droit. Dans 5 observations, il est mentionné un syndrome d’hyperstimulation ovarienne sévère associé.
Au total, 47 effets indésirables ont été cotés comme « autres ». Il s’agit pour les effets non graves essentiellement de syndromes d’hyperstimulation ovarienne sans hospitalisation de plus de 24 heures et pour les effets graves de torsions d’annexes, de douleurs abdominales, de fièvre.
Figure AMPV6. Nombre d'incidents et d'effets indésirables relatifs à la stimulation ovarienne en fonction de la gravité (n = 292, 2012)
Événements indésirables relatifs à un geste clinique lors de l’AMP
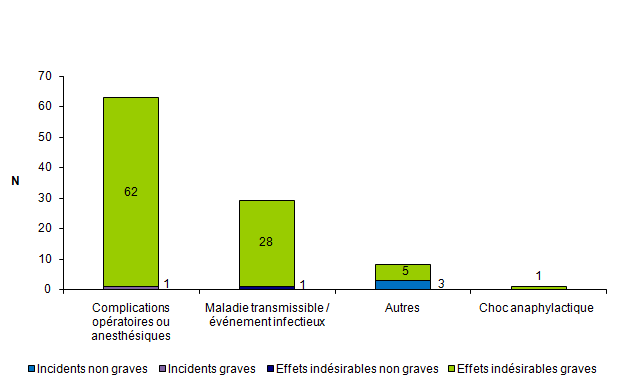
En 2012, 101 (21 %) événements indésirables sont en lien avec un geste clinique lors de l’AMP (insémination, ponction folliculaire, transfert embryonnaire, ...). Ces événements sont répartis en 97 effets indésirables (96 effets indésirables graves et 1 effet indésirable non grave) et 4 incidents (1 incident grave et 3 incidents non graves).
Parmi les 101 événements associés à un geste clinique lors de l’AMP, 63 (62 %) concernent des complications opératoires ou anesthésiques tels que des hémopéritoines, des hématomes ovariens, des allergies médicamenteuses et 29 % (29/101) des infections. En 2012, parmi les 63 complications opératoires ou anesthésiques, 35 observations concernent des hémopéritoines (cf. fig.AMPV7).
Figure AMPV7. Nombre d'incidents et d'effets indésirables relatifs à un geste clinique lors de l'AMP en fonction de la gravité (n = 101, 2012)
Événements indésirables relatifs à une perte de gamètes ou d’embryons
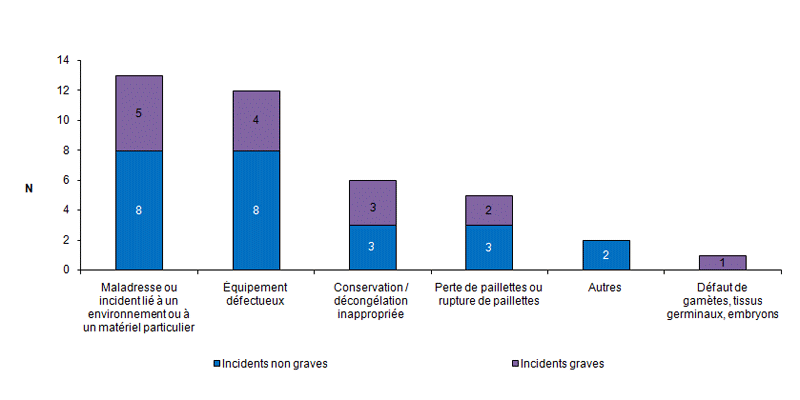
Trente-neuf événements indésirables (8 %) rapportés en 2012 concernent des incidents relatifs à la perte ou à la destruction accidentelle partielle ou totale de gamètes ou d’embryons.
Il s’agit le plus souvent d’incidents non graves (62 %). La plupart de ces incidents (64 %) sont en rapport avec une maladresse ou avec un équipement ou un matériel défectueux (cf. fig.AMPV8).
Figure AMPV8. Nombre d'incidents relatifs à la perte ou à la destruction accidentelle de gamètes/embryons en fonction de la gravité (n = 39, 2012)
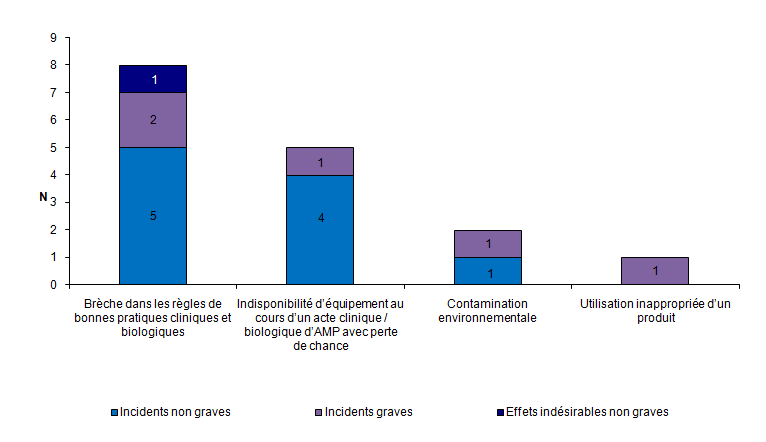
Événements indésirables relatifs à la structure
En 2012, 16 événements indésirables relatifs à la structure ont été rapportés. Il s’agit essentiellement d’incidents (94 %), le plus souvent non graves (63 %). La typologie la plus souvent rapportée concerne une brèche dans les règles de bonnes pratiques cliniques et biologiques telles que définies dans l’arrêté du 3 août 2010 (50 %) (cf. fig.AMPV9).
Figure AMPV9. Nombre d'incidents et d’effets indésirables relatifs à la structure en fonction de la gravité (n = 16, 2012)
Événements indésirables classés comme « divers »
En 2012, 29 événements indésirables ont été regroupés en « divers ». Ces événements comprennent 7 incidents relatifs à l’identification / attribution des gamètes ou des embryons, 5 concernant la culture des gamètes/embryons, 2 effets indésirables relatifs à une morbidité ou à un décès, et 15 classés comme autres.
Événements indésirables impliquant d’autres systèmes de vigilance sanitaire
En 2012, parmi les 477 signalements, 87 d’entre eux ont été transmis par le centre d’AMP à un autre système de vigilance sanitaire. Il s’agit le plus souvent de la pharmacovigilance (n = 42) et de la matériovigilance (n = 17).
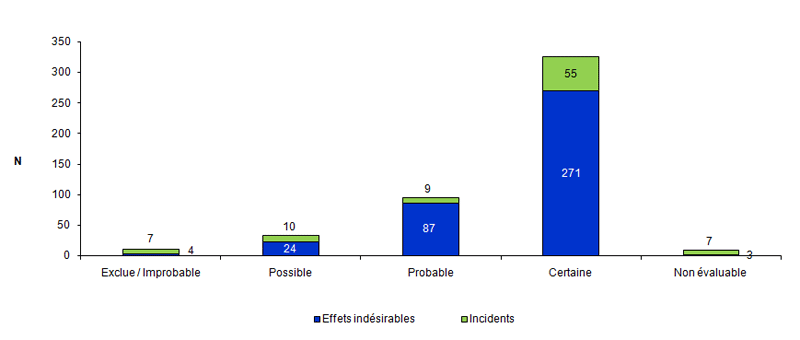
Distribution des incidents et des effets indésirables en fonction de l’imputabilité
Selon la fiche de déclaration d’AMP vigilance et la méthodologie développée dans le guide de remplissage de la fiche de déclaration d’AMP vigilance, le déclarant doit évaluer l’imputabilité de l’incident ou de l’effet indésirable selon une échelle d’imputabilité proposée par l’Agence de la biomédecine.
L’imputabilité a été cotée le plus souvent comme certaine (68 %) à la fois pour les incidents (62 %) et les effets indésirables (70 %) (Cf. fig.AMPV10).
Figure AMPV10. Nombre d’incidents et d’effets indésirables en fonction de l’imputabilité (n = 477, 2012)
Pour plus d’informations, le rapport annuel d’AMP vigilance 2012 adressé au ministre en charge de la santé est téléchargeable à partir de juillet 2013 sur le site de l’Agence de la biomédecine (http://www.agence-biomedecine.fr/professionnels/amp-vigilance.html)
1. Décret n°2008-588 du 19 juin 2008 transposant en matière de don de gamètes et d’assistance médicale à la procréation la directive 2004/23/CE du Parlement européen et du Conseil du 31 mars 2004
