Biovigilance
Organes
- Qu’est-ce que la Biovigilance ?
- Les acteurs de la Biovigilance
- Correspondants Biovigilance
- La déclaration de Biovigilance
- Guide pratique d’aide à la mise en place de la biovigilance dans un établissement de santé
- Lettre d’information BioVigilance’infos
- Rapports annuels de synthèse de biovigilance
- Recommandations/Mises au point
- Textes juridiques
Qu’est-ce que la Biovigilance
La biovigilance consiste à :
![]() surveiller les risques liés à l’utilisation à des fins thérapeutiques d’éléments et produits issus du corps humain tels les organes, les tissus, les cellules, et le lait maternel à usage thérapeutique.
surveiller les risques liés à l’utilisation à des fins thérapeutiques d’éléments et produits issus du corps humain tels les organes, les tissus, les cellules, et le lait maternel à usage thérapeutique.
A noter : Les produits sanguins labiles relèvent de l’hémovigilance ; les gamètes, embryons et tissus germinaux de la vigilance relative à l’assistance médicale à la procréation (AMP vigilance).
Elle est basée sur le signalement et la déclaration des incidents graves et des effets indésirables inattendus liés, ou susceptibles d’être liés, aux produits ou aux activités associées : prélèvement, collecte, préparation, transport, distribution, cession, délivrance, importation, exportation, greffe, administration.
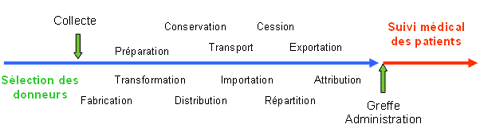
Discipline complexe, la biovigilance nécessite une veille sanitaire sur l’ensemble des étapes de la chaîne allant des sélections clinique et biologique du donneur au suivi médical des patients, donneurs vivants ou receveurs en post-administration ou post-greffe.
La biovigilance repose :
![]() sur la surveillance de façon systématique de tous les incidents et de tous les effets indésirables ;
sur la surveillance de façon systématique de tous les incidents et de tous les effets indésirables ;
![]() le signalement sans délai, par l’ensemble de ces professionnels, de tout incident grave et de tout effet indésirable inattendu au correspondant local de biovigilance ;
le signalement sans délai, par l’ensemble de ces professionnels, de tout incident grave et de tout effet indésirable inattendu au correspondant local de biovigilance ;
![]() la déclaration sans délai à compter de leur signalement des incidents graves et des effets indésirables inattendus à l’Agence de la biomédecine ;
la déclaration sans délai à compter de leur signalement des incidents graves et des effets indésirables inattendus à l’Agence de la biomédecine ;
![]() l’analyse et l’évaluation locale et nationale de ces informations en vue de limiter la probabilité de survenue de tout nouvel incident grave ou effet indésirable inattendu ou d’en diminuer la gravité.
l’analyse et l’évaluation locale et nationale de ces informations en vue de limiter la probabilité de survenue de tout nouvel incident grave ou effet indésirable inattendu ou d’en diminuer la gravité.
On entend par surveillance le fait pour les professionnels intervenant dans les activités relatives à la biovigilance d’enregistrer tous les incidents et les effets indésirables afin de signaler les événements inattendus et de déterminer la fréquence de survenue des événements attendus.
On entend par incident grave tout accident ou erreur lié aux activités portant sur les éléments ou produits issus du corps humain entraînant ou susceptible d’entraîner un effet indésirable grave ou inattendu, une perte importante de l’élément ou du produit empêchant la réalisation de la greffe ou de l’administration du produit ou toute fréquence anormalement élevée de survenue d’incident ou d’effets indésirables attendus.
On entend par effet indésirable toute réaction nocive survenant les personnes prélevées ou greffées.
On entend par effet indésirable grave tout effet indésirable ayant entraîné la mort ou ayant mis la vie en danger, entraîné des séquelles permanentes ou provoqué ou prolongé une hospitalisation ou tout autre état morbide.
On entend par effet indésirable inattendu (ou « inacceptable »), tout effet indésirable, grave ou non grave, dont la nature, la sévérité l’évolution n’est pas attendue au regard des référentiels établis par l’Agence de la biomédecine ou compte tenu de l’état de santé de la personne.
On entend par effet indésirable attendu (ou « acceptable »), tout effet indésirable dont le risque de survenue est connu et mentionné dans le référentiel publié par l’Agence de la biomédecine dans l’indication thérapeutique concernée.
Les acteurs de la Biovigilance
Le professionnels de santé
Les professionnels de santé (médecin, pharmacien, chirurgien-dentiste, sage-femme, infirmier), habilités à prélever, à collecter, à greffer ou à administrer les produits de santé d’une part et à assurer le suivi médical des patients d’autre part, jouent un rôle fondamental dans le système national de biovigilance. Ce sont eux qui, lorsqu’ils ont connaissance d’un événement indésirable, qu’il s’agisse d’un incident sur la chaîne allant du prélèvement à l’administration/greffe ou d’un effet indésirable chez un patient ou un donneur, ont pour mission d’en surveiller la fréquence de survenue, de signaler à leur correspondant local de biovigilance s’il s’agit d’un incident grave ou d’un effet indésirable inattendu, voire de le déclarer directement à l’Agence de la biomédecine en l’absence de correspondant local.
D’autres professionnels, et en particulier ceux impliqués dans les activités de préparation, conservation, distribution, cession, importation ou exportation des produits relevant de la biovigilance font partie du système national de biovigilance et doivent également surveiller, signaler ou déclarer les incidents ou effets indésirables qu’ils constatent ou sont portés à leur connaissance.
Ces professionnels exercent leurs activités dans des établissements de santé, ainsi que toute autre structure publique ou privée qui exerce des activités :
![]() de prélèvement ou de collecte des produits biologiques relevant de la biovigilance ;
de prélèvement ou de collecte des produits biologiques relevant de la biovigilance ;
![]() de transformation, préparation, conservation, distribution, cession, importation ou exportation de ces produits. Il s’agit, par exemple, des banques de tissus ou de cellules, des laboratoires de thérapie cellulaire et des lactariums qui réalisent une ou plusieurs étapes du procédé de transformation de l’élément du corps humain prélevé ou collecté en vue de son utilisation thérapeutique ;
de transformation, préparation, conservation, distribution, cession, importation ou exportation de ces produits. Il s’agit, par exemple, des banques de tissus ou de cellules, des laboratoires de thérapie cellulaire et des lactariums qui réalisent une ou plusieurs étapes du procédé de transformation de l’élément du corps humain prélevé ou collecté en vue de son utilisation thérapeutique ;
![]() d’administration ou de greffe des produits relevant de la biovigilance.
d’administration ou de greffe des produits relevant de la biovigilance.
![]() de prise en charge de patients ou de donneurs.
de prise en charge de patients ou de donneurs.
L’Agence de la biomédecine
L’Agence de la biomédecine est l’autorité compétente en matière de biovigilance :
![]() elle veille à la sécurité sanitaire des organes, tissus, cellules et du lait maternel à usage thérapeutique,
elle veille à la sécurité sanitaire des organes, tissus, cellules et du lait maternel à usage thérapeutique,
![]() elle assure la mise en œuvre du système national de biovigilance,
elle assure la mise en œuvre du système national de biovigilance,
![]() à la lumière des informations de biovigilance, elle définit les orientations de la biovigilance et veille à ce que les différents partenaires du réseau respectent les procédures établies,
à la lumière des informations de biovigilance, elle définit les orientations de la biovigilance et veille à ce que les différents partenaires du réseau respectent les procédures établies,
![]() elle anime et coordonne les actions des différents intervenants,
elle anime et coordonne les actions des différents intervenants,
![]() elle est chargée de mettre en place et d’animer le système national de biovigilance.
elle est chargée de mettre en place et d’animer le système national de biovigilance.
Son rôle consiste notamment à :
![]() évaluer toutes les déclarations d’incidents ou d’effets indésirables qui lui parviennent. Pour cela, elle est en liaison permanente avec les autres directions de l’Agence de la biomédecine (DPGOT, DPGCSH …) mais également avec les autres vigilances régulées par l’ANSM (matériovigilance, réactovigilance, pharmacovigilance, …),
évaluer toutes les déclarations d’incidents ou d’effets indésirables qui lui parviennent. Pour cela, elle est en liaison permanente avec les autres directions de l’Agence de la biomédecine (DPGOT, DPGCSH …) mais également avec les autres vigilances régulées par l’ANSM (matériovigilance, réactovigilance, pharmacovigilance, …),
![]() répondre aux demandes de tout interlocuteur en matière de biovigilance,
répondre aux demandes de tout interlocuteur en matière de biovigilance,
![]() animer le réseau en allant à la rencontre des acteurs sur le terrain,
animer le réseau en allant à la rencontre des acteurs sur le terrain,
![]() informer les professionnels de santé des procédures et des recommandations établies,
informer les professionnels de santé des procédures et des recommandations établies,
![]() mettre en place et animer des groupes de réflexions scientifique et méthodologique,
mettre en place et animer des groupes de réflexions scientifique et méthodologique,
![]() analyser les rapports de synthèse de biovigilance des CLB et rédiger, en partie à partir de ces rapports, le rapport annuel de la biovigilance destiné à la Ministre de la santé et à la Commission européenne.
analyser les rapports de synthèse de biovigilance des CLB et rédiger, en partie à partir de ces rapports, le rapport annuel de la biovigilance destiné à la Ministre de la santé et à la Commission européenne.
Vos interlocuteurs à L’Agence de la biomédecine
Le Pôle sécurité-qualité, Cellule de biovigilance / secrétariat
Tel : 01 55 93 64 53
Fax : 01 55 93 69 36
Mèl : biovigilance@biomedecine.fr
L’Agence national de sécurité du médicament et des produits de santé (ANSM)
L’agence nationale de sécurité du médicament et des produits de santé procède à l’évaluation des bénéfices et des risques liés à l’utilisation des produits à finalité sanitaire destinés à l’homme comprenant notamment les organes, les tissus, les cellules, les préparations de thérapie cellulaire et le lait maternel issu de lactariums.
A ce titre elle évalue les risques a priori et effectue des réévaluations des bénéfices et des risques au vu des données de vigilance. Elle peut également mettre en place des mesures de police sanitaire. Aussi, l’Agence de la biomédecine transmet à l’ANSM les éléments lui permettant de prendre les mesures qu’elle estime nécessaire si elle constate après évaluation que les informations qui lui sont déclarées nécessitent des mesures relevant de ses prérogatives.
L’ANSM reste la structure en charge des essais cliniques et reçoit à ce titre les déclarations relatives aux événements indésirables observés dans le cadre d’une recherche biomédicale portant sur un organe, un tissu, du lait maternel à usage thérapeutique ou une préparation de thérapie cellulaire (www.ansm.sante.fr).
Seuls les effets indésirables observés chez un donneur ou un patient lors du prélèvement relèvent à la fois de la biovigilance et de la vigilance relative aux essais cliniques et devront dès lors être déclarés dans les deux domaines.
Correspondants locaux BioVigilance
Chaque établissement participant aux activités relevant du champ de la biovigilance doit désigner au moins un correspondant local de biovigilance (CLB) et son suppléant.
Chaque correspondant local de biovigilance doit être doté d’une expérience concernant les produits ou activités relevant de ses missions.
L’identité, la qualité, ainsi que l’expérience professionnelle (curriculum vitae) de chaque correspondant local de biovigilance et de son suppléant, nommés par le responsable de l’établissement ou de la structure concerné(e), doivent être communiquées au directeur général de l’Agence de la biomédecine, via la fiche d’identification.
Au plus 5 correspondants locaux (et 5 suppléants) de biovigilance peuvent être désignés par établissement, en fonction des activités effectivement réalisées dans l’établissement, à savoir :
![]() un CLB pour les activités de prélèvements d’organes ;
un CLB pour les activités de prélèvements d’organes ;
![]() un CLB pour les activités de greffes d’organes ;
un CLB pour les activités de greffes d’organes ;
![]() un CLB pour les activités tissus (à désigner parmi le personnel de la banque de tissus si l’établissement dispose d’une telle structure) ;
un CLB pour les activités tissus (à désigner parmi le personnel de la banque de tissus si l’établissement dispose d’une telle structure) ;
![]() un CLB pour les activités cellules/préparations de thérapie cellulaire (à désigner parmi le personnel du laboratoire de thérapie cellulaire si l’établissement dispose d’une telle structure) ;
un CLB pour les activités cellules/préparations de thérapie cellulaire (à désigner parmi le personnel du laboratoire de thérapie cellulaire si l’établissement dispose d’une telle structure) ;
![]() un CLB pour les activités lait maternel à usage thérapeutique (à désigner parmi le personnel du lactarium si l’établissement dispose d’une telle structure).
un CLB pour les activités lait maternel à usage thérapeutique (à désigner parmi le personnel du lactarium si l’établissement dispose d’une telle structure).
A remplir et retourner
par courrier :
Agence de la biomédecine
Pôle des données
1, avenue du stade de France
93212 SAINT-DENIS LA PLAINE CEDEX
ou
par mèl à biovigilance@biomedecine.fr
Après réception de toutes ces informations, les correspondants locaux de biovigilance sont inscrits dans l’annuaire national des correspondants locaux de biovigilance géré par l’Agence de la biomédecine.
En cas de remplacement d’un correspondant local de biovigilance ou bien de modifications de ses coordonnées, une nouvelle fiche d’identification devra être saisie et envoyée à l’Agence de la biomédecine.
La déclaration de BioVigilance
Tout incident grave ou effet indésirable inattendu doit être déclaré sans délai à l’Agence de la biomédecine à l’aide de la fiche de déclaration.
A remplir et retourner
préférentiellement par mèl à :biovigilance@biomedecine.fr
ou
Par courrier :
Agence de la biomédecine
Pôle sécurité-qualité / cellule biovigilance
1, avenue du stade de France
93212 SAINT-DENIS LA PLAINE CEDEX
Guide pratique d’aide à la mise en place de la biovigilance dans un établissement de santé
Ce document, présenté sous la forme d’annexes, est destiné avant tout aux correspondants locaux de biovigilance. Il devrait leur permettre de préciser, au sein de leur établissement respectif, les circuits de signalement et de déclaration des incidents et des effets indésirables ainsi que le rôle des différents acteurs impliqués, notamment dans le cadre d’une enquête de biovigilance.
Lettre d’information « Biovigilance’ infos »
Destinée à favoriser le retour d’information vers les professionnels concernés, n’hésitez pas à la relayer et à faire part de vos retours à la direction générale médicale et scientifique - Pôle Sécurité-Qualité : biovigilance@biomedecine.fr
2023
2022
2019
2018
Les rapports annuels de synthèse de biovigilance
Consulter les rapports annuels de synthèses de Biovigilance des années antérieures (mots clés : Organes + Vigilance + Rapport d’activités)
Recommandations/Mises au point
La maîtrise de la phase pré-analytique est un élément majeur pour garantir aux laboratoires de biologie médicale (LBM) et aux laboratoires de qualification biologique des dons de l’établissement français du sang (EFS) la mise à disposition d’un échantillon conforme permettant la réalisation des analyses de qualification microbiologique des donneurs dans les meilleures conditions. Cette phase, critique pour la qualité des résultats des examens rendus par les laboratoires, s’étend du prélèvement du patient/donneur à l’obtention d’un échantillon prêt pour la réalisation de l’examen.
L’Agence de la biomédecine (ABM) et l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) publient une mise au point sur cette thématique.
Il s’agit de recommandations qui peuvent être utilisée par les LBM et le personnel de santé participant aux prélèvements des échantillons sur le donneur de différentes façons :
![]() Une aide décisionnelle en cas de prélèvement hémodilué ou d’échantillon prélevé en chambre mortuaire ;
Une aide décisionnelle en cas de prélèvement hémodilué ou d’échantillon prélevé en chambre mortuaire ;
![]() Une aide à la rédaction de procédures, modes opératoires, instructions ou formulaires d’enregistrement pour la phase pré-analytique concernant les échantillons destinés au dépistage de certaines maladies infectieuses transmissibles chez des donneurs d’organes, de tissus ou de cellules ;
Une aide à la rédaction de procédures, modes opératoires, instructions ou formulaires d’enregistrement pour la phase pré-analytique concernant les échantillons destinés au dépistage de certaines maladies infectieuses transmissibles chez des donneurs d’organes, de tissus ou de cellules ;
![]() Une aide à la communication entre les fabricants, les biologistes, les cliniciens ou les préleveurs en proposant des supports (par exemple : liste des principaux réactifs et conditions prévues par les fabricants vis-à-vis de la qualification des donneurs, modèle de fiche de prescription).
Une aide à la communication entre les fabricants, les biologistes, les cliniciens ou les préleveurs en proposant des supports (par exemple : liste des principaux réactifs et conditions prévues par les fabricants vis-à-vis de la qualification des donneurs, modèle de fiche de prescription).
Ces recommandations annulent et remplacent les précédentes recommandations de mars 2004.