En 2017, 75 centres français ont réalisé des greffes de cellules souches hématopoïétiques (CSH). Cette activité est divisée en deux catégories : greffes allogéniques et greffes autologues. Parmi ces 75 centres, 39 n’ont réalisé que des autogreffes, 1 n’a réalisé que des allogreffes et 35 ont eu une activité mixte.
En 2017, 5 070 patients ont reçu un ou plusieurs greffons de CSH autologues ou allogéniques, soient 3 198 patients pour 3 322 greffes autologues et 1 872 patients pour 1 902 greffes allogéniques. Ces résultats sont établis sur la base de la déclaration des centres de greffe à l’Agence de la biomédecine. L’analyse de l’activité 2017 (Tableau CSH G1) montre une relative augmentation du nombre de greffes autologues et une légère baisse du nombre de greffes allogéniques par rapport à 2016.
Tableau CSH G1. Evolution du nombre de greffes de CSH
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
2016 |
2017 |
|
Nombre de greffes autologues |
2951 |
2675 |
3047 |
3003 |
2766 |
3034 |
3118 |
3125 |
3151 |
3322 |
Nombre de greffes allogéniques |
1472 |
1539 |
1656 |
1772 |
1721 |
1872 |
1966 |
1964 |
1958 |
1902 |
dont greffes non apparentées |
841 |
902 |
937 |
1023 |
1011 |
1090 |
1110 |
1043 |
1060 |
998 |
Nombre total de greffes |
4423 |
4214 |
4703 |
4775 |
4487 |
4906 |
5084 |
5089 |
5109 |
5224 |
Source : déclarations d’activité des centres de greffe
Matériel et méthodes
Données
Mode de recueil
Depuis 1995, l’Etablissement français des Greffes, puis l’Agence de la biomédecine, recueille chaque année :
- des informations quantitatives relatives aux greffes : le nombre total de greffes réalisées et le nombre total de patients greffés, par centre et par type de greffe (ces chiffres sont reportés dans les Tableaux CSH G2,CSH G8, CSH G9)
- des informations qualitatives concernant chaque nouvelle greffe réalisée pendant l’année en cours (diagnostic, état de la maladie à la greffe, …).
Par ailleurs, le suivi des patients greffés les années précédentes est actualisé.
Le nombre total de greffes réalisées et le nombre total de patients greffés sont obtenus d’une part par les fiches d’activité papier recueillies auprès de chaque centre, et d’autre part par une extraction des données de la base ProMISe (base de données de l’EBMT, gérée à Londres). Lors du contrôle qualité effectué par l’Agence de la biomédecine, ces deux sources de données sont comparées et en cas de discordance, des demandes de correction sont envoyées aux centres de greffe. Par ailleurs le nombre de greffes allogéniques non apparentées (Tableaux CSH G7, CSH G9, figure CSH G6) est comparé pour chaque centre au nombre de prélèvements de greffons de CSH réalisés pour des patients français et recensés par le Registre France Greffe de Moelle (Tableau RFGM 8). Les discordances qui persistent après contrôle auprès des centres sont dues essentiellement au fait que certains greffons ne sont pas infusés (état du patient), ou que certains greffons prélevés en fin d’année sont infusés au début de l’année suivante, ou encore au fait que des fractions de greffons prélevés les années antérieures ont été congelées puis infusées plus tardivement aux patients.
Population étudiée - Exhaustivité
La base de données constituée par l’extraction au 30 juin 2018 des données saisies dans ProMISe par les 75 centres de greffe de CSH, comprend pour les greffes 2017 :
- 1 777 allogreffes réalisées pour 1 750 patients ; l’exhaustivité des données est de 93,4% par rapport aux chiffres d’activité communiqués par les centres et repris dans les tableaux CSH G1, CSH G8 et CSH G9 ;
- 2 474 autogreffes réalisées sur 2 363 patients ; l’exhaustivité est de 74,5% par rapport aux chiffres d’activité communiqués par les centres et repris dans les tableaux CSH G1 et CSH G2.
Pour l’étude de la survie des patients après allogreffe de CSH, la base de données contient 27 512 patients ayant reçu une allogreffe entre 1995 et 2017. Cette cohorte continue à être considérée dans son ensemble pour améliorer l’interprétation du suivi de certaines pathologies dont l’effectif est faible (aplasies). Cependant, pour l’étude d’autres pathologies dont l’effectif est suffisant, cette base de données a été réduite à une cohorte plus récente (2002-2017).
Parmi ces patients, ont été exclus ceux dont l’une des variables de suivi (état aux dernières nouvelles ou date de dernières nouvelles) était manquante, soient 233 patients (0,8%). La base finale contenait donc 27 279 patients, dont 14 349 (52,6%) allogreffés à partir d’un donneur apparenté, 12 853 (47,1%) allogreffés à partir d’un donneur non apparenté et 77 (0,3%) pour lesquels le type de donneur était manquant.
Le suivi des patients dans ProMISe est saisi grâce à l’état du patient à la date de dernières nouvelles. Le critère étudié est le délai entre la date de greffe et la date de dernières nouvelles. La plupart des centres de greffe suit les patients allogreffés annuellement pendant au moins 5 ans après la greffe. Au-delà de 5 ans, les patients sont parfois suivis uniquement en ville et leur suivi après 5 ans peut donc n’être pas saisi dans ProMISe.
Pour connaître la qualité du suivi des patients dans ProMISe, nous avons choisi de calculer trois indicateurs : le pourcentage de suivis manquants à 1 an, 3 ans et 5 ans. Le pourcentage de suivis manquants à 1 an se calcule sur la cohorte des patients allogreffés entre 1995 et 2016 (pour lesquels on dispose d’un recul d’au moins 1 an après la greffe). Parmi ces patients, certains ont une date de dernières nouvelles au-delà de 1 an post-greffe, d’autres sont indiqués morts avant 1 an, et d’autres sont indiqués vivants avant 1 an. Ce sont ces derniers qui sont considérés comme ayant un suivi manquant à 1 an. On procède de même pour calculer le pourcentage de suivis manquants à 3 ans (sur la cohorte des patients pour lesquels on a au moins trois ans de recul : patients allogreffés entre 1995 et 2014) et le pourcentage de suivis manquants à 5 ans (sur la cohorte des patients allogreffés entre 1995 et 2012).
Dans la base extraite de ProMISe en juin 2018, le pourcentage de suivis manquants à 1 an est de 7,5%. Les suivis manquants à 1 an concernent, à 77%, des greffes réalisées de 2013 à 2016. Le pourcentage de suivis manquants à 3 ans est de 13%. Les suivis manquants à 3 ans concernent, à 70%, des greffes réalisées de 2011 à 2014. Le pourcentage de suivis manquants à 5 ans est de 16,5%. Les suivis manquants à 5 ans concernent, à 52,5%, des greffes réalisées de 2010 à 2012. Ceci montre que plus on s’éloigne de la greffe moins le suivi est exhaustif dans la base ProMISe.
Méthodes statistiques
Les résultats présentés sur les greffes de l’année 2017 ont été obtenus à l’aide des procédures de statistique descriptive du logiciel SAS (version 9.3).
Pour l’étude de la survie des patients après allogreffe de CSH, le critère étudié est la durée de survie du patient après la greffe quel que soit le nombre de greffes reçues. Pour un patient ayant reçu plusieurs greffes, il est défini comme le délai entre la date de la première greffe, et la date des dernières nouvelles de la dernière greffe. On regarde également l’état du patient à la date de dernières nouvelles (vivant / décédé). La date de point a été fixée au 30 juin 2018. Si la date de dernières nouvelles dépasse la date de point, le patient sera considéré vivant à la date de point. Les courbes de survie ont été réalisées par la méthode actuarielle et les estimations de la probabilité de survie à différents délais ont été calculées par la méthode de Kaplan-Meier. Pour chaque courbe est également indiquée la médiane de survie, c’est-à-dire le temps au bout duquel 50% des patients sont encore en vie.
Ces résultats sont à interpréter avec prudence. Ils ne donnent qu’une idée globale de la survie des patients après allogreffe de CSH. En effet, la plupart des courbes représentées ne prennent en compte qu’un seul facteur : l’indication de la greffe. Pour apprécier plus précisément l’efficacité de la greffe, il est indispensable de tenir compte de l’ensemble des facteurs pronostiques potentiels.
Activité d’autogreffe globale
En 2017, tous les centres répertoriés par l’Agence de la biomédecine, à l’exception de l’un d’entre eux, ont déclaré leur activité d’autogreffe : 3 322 greffes autologues ont été réalisées pour 3 198 patients qui ont reçu une ou plusieurs autogreffes. Les chiffres des 10 dernières années montrent une augmentation modérée de 15% de l’activité d’autogreffe (Figure CSH G1).
Les greffes autologues ont été réalisées par 74 équipes, parmi lesquelles 29 ont réalisé chacune 50 autogreffes ou plus et 12 moins de 10 autogreffes. La pertinence du maintien de l’activité dans les centres effectuant un faible nombre annuel d’autogreffes reste à discuter. Dans 99,9% des cas, le greffon est constitué de cellules souches hématopoïétiques issues du sang périphérique.
Le tableau CSH G2 rapporte l’activité d’autogreffe telle qu’elle a été déclarée par chaque centre. Dans la colonne centrale est notée l’activité extraite de la base de données ProMISe. En grisé sont indiqués les centres qui ont saisi dans ProMISe moins des trois quarts des greffes réalisées, soit 34% de la totalité des centres.
L’exhaustivité très imparfaite du recueil de cette activité (25,5% de greffes non saisies) contraste avec la meilleure qualité des données concernant l’activité d’allogreffe (6,6% de greffes non saisies). Il est à noter que la plupart des centres mixtes avec activités d’autogreffe et d’allogreffe ont entamé une démarche qualité dans le cadre de l’accréditation européenne JACIE dans laquelle la traçabilité exhaustive de l’activité est obligatoire. Le manque d’exhaustivité des données recueillies peut être mis en regard de l’insuffisance de moyens dédiés au recueil des données dans certains centres.
L’âge moyen des patients recevant une greffe de CSH autologue est de 53 ans. L’âge médian de ces patients est de 58 ans et 21% d’entre eux ont plus de 65 ans (Figure CSH G2).
Indications thérapeutiques
En 2017, le nombre de patients ayant bénéficié d’une autogreffe est de 3 198. Parmi eux, 2 363 patients ont eu leurs données saisies dans la base européenne ProMISe (74%), ce qui permet de répartir les indications d’autogreffe comme suit : 2 187 patients ont été traités pour hémopathies malignes (92,6%), 171 (soit 7,2%) pour une tumeur solide et 5 patients (0,2%) ont été traités pour une maladie auto-immune (Tableau CSH G3, Figures CSH G3, CSH G4 et CSH G5). Néanmoins, les données de 835 patients n’ayant pas été saisies, cette répartition des indications est à interpréter avec réserve.
Les lymphomes et les myélomes représentent respectivement 38,4% et 57,2% des indications d’autogreffe pour hémopathie, et restent donc les indications majeures d’autogreffe (Figure CSH G4). Les autogreffes pour tumeur solide sont majoritairement réalisées dans le cadre de neuroblastomes, d’autres tumeurs du système nerveux ou de tumeurs germinales (Figure CSH G5). Les autres indications minoritaires sont multiples et controversées (Figure CSH G3, Figure CSH G4, Figure CSH G5).
Figure CSH G1. Evolution du nombre de patients ayant eu une autogreffe de CSH
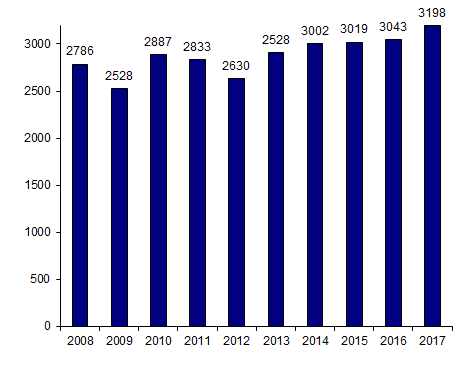
Source : déclarations d’activité des centres de greffe
Tableau CSH G2. Evolution de l'activité d'autogreffe de CSH par équipe
Nombre d'autogreffes |
ProMISe |
Nombre de patients |
|||||||
2014 |
2015 |
2016 |
2017 |
2017 |
2014 |
2015 |
2016 |
2017 |
|
Amiens Hôpital Sud |
36 |
57 |
55 |
41 |
41 |
36 |
57 |
55 |
41 |
Angers CHU |
61 |
44 |
53 |
52 |
52 |
57 |
44 |
53 |
52 |
Argenteuil CH Victor Dupouy |
18 |
20 |
21 |
17 |
0 |
18 |
20 |
21 |
17 |
Bayonne Centre Hospitalier |
19 |
31 |
32 |
23 |
23 |
19 |
29 |
29 |
23 |
Besançon Hôpital Jean Minjoz |
43 |
33 |
39 |
52 |
52 |
41 |
33 |
38 |
49 |
Bobigny Hôpital Avicenne |
36 |
34 |
18 |
34 |
0 |
35 |
34 |
18 |
34 |
Bordeaux Groupe Hospitalier Pellegrin |
13 |
8 |
3 |
12 |
12 |
9 |
6 |
3 |
9 |
Bordeaux Pessac Hôpital Haut Lévêque |
132 |
126 |
107 |
128 |
127 |
127 |
120 |
106 |
125 |
Boulogne/Mer Hôpital Duchenne |
9 |
20 |
24 |
16 |
16 |
9 |
18 |
24 |
16 |
Brest Hôpital Augustin Morvan |
41 |
44 |
49 |
60 |
60 |
40 |
40 |
49 |
60 |
Caen Centre Régional François Baclesse |
28 |
/ * |
/ * |
/ * |
/ * |
27 |
/ * |
/ * |
/ * |
Caen CHU |
52 |
66 |
61 |
67 |
3 |
47 |
66 |
61 |
66 |
Clamart Hôpital d'Instruction des Armées |
41 |
35 |
53 |
28 |
28 |
41 |
35 |
53 |
28 |
Clermont-Ferrand |
76 |
60 |
61 |
69 |
22 |
76 |
60 |
61 |
67 |
Colmar Hôpital Louis Pasteur |
16 |
10 |
23 |
NC§ |
1 |
16 |
10 |
23 |
NC§ |
Corbeil Hôpital Gilles de Corbiel |
13 |
24 |
25 |
21 |
0 |
13 |
24 |
25 |
21 |
Créteil Hôpital Henri Mondor |
4 |
1 |
1 |
6 |
6 |
4 |
1 |
1 |
6 |
- unité Hémopathies Lymphoïdes |
28 |
50 |
41 |
43 |
44# |
28 |
50 |
41 |
43 |
Dijon Hôpital Le Bocage |
105 |
105 |
99 |
108 |
108 |
94 |
105 |
92 |
100 |
Dunkerque Centre Hospitalier |
11 |
20 |
9 |
9 |
2 |
11 |
20 |
9 |
9 |
Grenoble CHU |
48 |
61 |
48 |
60 |
60 |
48 |
59 |
47 |
58 |
Lens Centre Hospitalier |
24 |
12 |
8 |
16 |
1 |
24 |
12 |
8 |
16 |
Lille Centre Hospitalier Saint-Vincent |
6 |
17 |
16 |
18 |
18 |
6 |
17 |
16 |
18 |
Lille Centre Oscar Lambret |
8 |
11 |
20 |
18 |
1 |
8 |
10 |
15 |
13 |
Lille CHU Claude Huriez |
30 |
43 |
50 |
45 |
45 |
30 |
43 |
50 |
45 |
Lille Hôpital Jeanne de Flandre |
1 |
1 |
2 |
1 |
1 |
1 |
1 |
2 |
1 |
Limoges Centre Hospitalier Dupuytren |
35 |
30 |
44 |
43 |
44# |
35 |
30 |
42 |
42 |
Lyon Centre Hospitalier Lyon Sud |
108 |
84 |
93 |
106 |
106 |
107 |
84 |
91 |
103 |
Lyon CRLC Léon Bérard |
72 |
74 |
63 |
75 |
71 |
66 |
71 |
62 |
74 |
Lyon Institut d'Hématologie et d'Oncologie Pédiatrique |
13 |
6 |
24 |
24 |
24 |
13 |
6 |
18 |
16 |
Marseille Hôpital de la Conception |
20 |
29 |
42 |
26 |
24 |
20 |
29 |
42 |
26 |
Marseille Hôpital de la Timone |
14 |
11 |
11 |
16 |
16 |
11 |
8 |
9 |
16 |
Marseille Institut Paoli Calmettes |
175 |
182 |
101 |
143 |
143 |
168 |
170 |
94 |
131 |
Meaux Centre Hospitalier |
19 |
13 |
18 |
18 |
17 |
19 |
12 |
17 |
18 |
Metz Hôpital Notre Dame de Bon Secours |
35 |
38 |
39 |
35 |
2 |
35 |
38 |
35 |
35 |
Montpellier Hôpital Saint-Eloi et Hôpital Arnaud de Villeneuve |
112 |
115 |
119 |
132 |
132 |
106 |
115 |
119 |
132 |
Mulhouse Hôpital Emile Muller |
29 |
21 |
22 |
25 |
25 |
29 |
21 |
21 |
25 |
Nancy Hôpital d’Adultes |
39 |
56 |
50 |
64 |
13 |
39 |
55 |
50 |
64 |
Nancy Hôpital d'Enfants |
8 |
7 |
3 |
6 |
0 |
6 |
7 |
2 |
3 |
Nantes Hôtel Dieu |
132 |
130 |
156 |
133 |
132 |
129 |
130 |
156 |
133 |
Nice Centre Antoine Lacassagne |
66 |
58 |
58 |
73 |
1 |
62 |
58 |
58 |
73 |
Nice Hôpital de l'Archet 1 |
24 |
26 |
19 |
26 |
26 |
24 |
24 |
19 |
23 |
Orléans CHR |
26 |
26 |
22 |
27 |
27 |
24 |
25 |
22 |
27 |
Paris Hôpital Cochin |
59 |
57 |
68 |
56 |
0 |
57 |
57 |
68 |
56 |
Paris Hôpital d'Enfants Armand Trousseau |
3 |
1 |
3 |
3 |
3 |
3 |
1 |
3 |
3 |
Paris Hôpital Necker |
39 |
38 |
37 |
31 |
0 |
39 |
38 |
37 |
31 |
- unité d'Hémato-Immunologie Pédiatrique |
3 |
0 |
0 |
0 |
0 |
3 |
0 |
0 |
0 |
Paris Hôpital Robert Debré |
0 |
0 |
1 |
2 |
0 |
0 |
0 |
1 |
2 |
Paris Hôpital Saint-Antoine |
74 |
93 |
85 |
72 |
72 |
74 |
92 |
85 |
72 |
Paris Hôpital Saint-Louis |
1 |
9 |
4 |
4 |
4 |
1 |
7 |
4 |
4 |
- service d’Onco-Hématologie |
36 |
33 |
42 |
48 |
47 |
36 |
33 |
42 |
48 |
- service d'Hématologie Adulte |
8 |
0 |
5 |
1 |
0 |
7 |
0 |
5 |
1 |
- service d’Immuno-Hématologie 1 |
35 |
40 |
59 |
70 |
0 |
35 |
40 |
59 |
70 |
Paris Hôpital Tenon |
35 |
33 |
39 |
30 |
17 |
20 |
16 |
19 |
18 |
Paris Institut Curie |
52 |
43 |
64 |
54 |
54 |
48 |
36 |
55 |
46 |
Paris La Pitié Salpetrière |
65 |
53 |
46 |
58 |
58 |
64 |
53 |
45 |
58 |
Poitiers Hôpital Jean Bernard |
54 |
48 |
76 |
86 |
85 |
54 |
48 |
71 |
85 |
Pontoise CH René Dubos |
17 |
23 |
20 |
25 |
25 |
17 |
23 |
20 |
25 |
Reims Hôpital Robert Debré |
39 |
51 |
35 |
55 |
0 |
39 |
51 |
35 |
55 |
Rennes CHU |
121 |
107 |
98 |
94 |
11 |
117 |
103 |
95 |
90 |
Roubaix Hôpital Provo |
15 |
15 |
10 |
10 |
10 |
15 |
15 |
10 |
10 |
Rouen Centre Henri Becquerel |
66 |
77 |
65 |
61 |
61 |
64 |
75 |
64 |
60 |
Rouen Hôpital Charles Nicolle |
7 |
9 |
14 |
3 |
3 |
5 |
6 |
10 |
2 |
Saint-Cloud Centre René Huguenin |
36 |
34 |
37 |
29 |
0 |
36 |
34 |
37 |
29 |
Saint-Denis (Réunion) CHD Félix Guyon |
7 |
14 |
9 |
12 |
0 |
7 |
14 |
9 |
12 |
Saint-Étienne |
38 |
36 |
45 |
44 |
44 |
38 |
36 |
45 |
43 |
Saint-Pierre (Réunion) CH François Dunan |
12 |
12 |
13 |
22 |
0 |
12 |
12 |
13 |
19 |
Saint Quentin Centre Hospitalier |
9 |
12 |
10 |
8 |
8 |
9 |
12 |
10 |
8 |
Strasbourg Hôpital de Hautepierre |
80 |
75 |
68 |
91 |
89 |
79 |
74 |
66 |
89 |
Toulouse CHU |
6 |
8 |
12 |
8 |
8 |
5 |
8 |
7 |
6 |
Toulouse Oncopôle |
103 |
113 |
120 |
133 |
133 |
103 |
108 |
120 |
133 |
Toulouse Institut Claudius Regaud |
3 |
5 |
1 |
0 |
0 |
1 |
2 |
1 |
0 |
Tours Hôpital Bretonneau |
80 |
70 |
70 |
63 |
59 |
80 |
65 |
70 |
63 |
Valenciennes Hôtel Dieu |
13 |
13 |
13 |
16 |
0 |
13 |
13 |
13 |
16 |
Versailles Hôpital André Mignot |
20 |
26 |
39 |
62 |
0 |
20 |
26 |
39 |
31 |
Villejuif Hôpital Paul Brousse |
6 |
4 |
3 |
1 |
1 |
5 |
4 |
3 |
1 |
Villejuif Institut Gustave Roussy : |
102 |
98 |
101 |
110 |
113# |
102 |
96 |
101 |
110 |
- service d'Oncologie Pédiatrique |
48 |
36 |
37 |
44 |
43 |
36 |
24 |
24 |
44 |
Total |
3118 |
3125 |
3151 |
3322 |
2474 |
3002 |
3019 |
3043 |
3198 |
§ Données non communiquées
*Centre ayant fusionné, début 2015, avec le CHU de Caen
# Nombre d'autogreffes saisies supérieur au nombre déclaré
En gris : Centre ayant saisi moins des trois quarts des greffes réalisées
Source : déclarations d’activité des centres de greffe
Figure CSH G2. Evolution de l'âge moyen des patients ayant eu une autogreffe de CSH
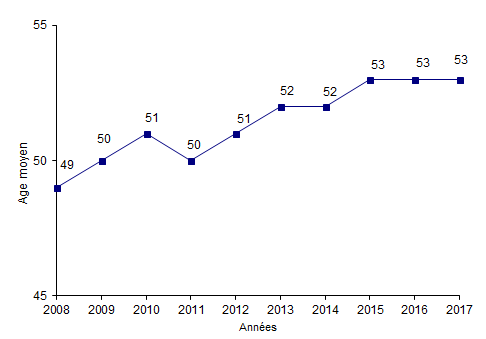
Source : Base ProMISe (extraction du 30 juin 2018)
Tableau CSH G3. Evolution de l’activité d’autogreffe de CSH, selon le type d’indication
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
2016 |
2017 |
|
Nombre de greffes autologues |
3095 |
3176 |
3121 |
2949 |
2860 |
2951 |
2675 |
3041 |
2995 |
2766 |
3034 |
3118 |
3125 |
3151 |
3322 |
Nombre de patients |
2695 |
2814 |
2777 |
2669 |
2627 |
2786 |
2528 |
2887 |
2833 |
2630 |
2907 |
3002 |
3019 |
3043 |
3198 |
Proportion d'hémopathies (%) |
86.7 |
87.8 |
88.3 |
88.5 |
88.8 |
89.4 |
90.2 |
90.4 |
89.2 |
91.1 |
90.8 |
90.8 |
93.6 |
94.2 |
92.6 |
Proportion de tumeurs solides (%) |
13.0 |
12.0 |
11.5 |
11.4 |
10.9 |
10.3 |
9.5 |
9.3 |
10.6 |
8.6 |
8.9 |
8.7 |
6.1 |
5.5 |
7.2 |
Proportion de maladie auto-immune (%) |
0.3 |
0.2 |
0.2 |
0.1 |
0.3 |
0.3 |
0.3 |
0.3 |
0.2 |
0.3 |
0.3 |
0.5 |
0.3 |
0.3 |
0.2 |
Source : Base ProMISe (extraction du 30 juin 2018)
Figure CSH G3. Evolution de la répartition des indications d’autogreffe de CSH
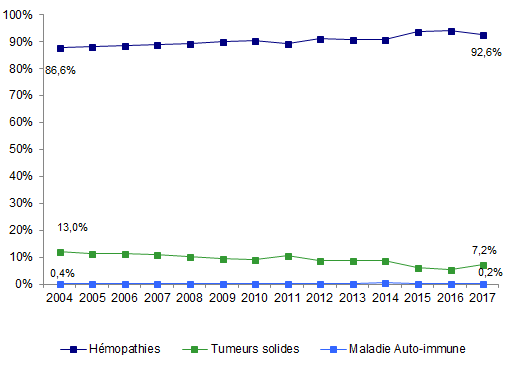
Source : Base ProMISe (extraction du 30 juin 2018)
Figure CSH G4. Répartition des diagnostics chez les patients ayant eu une autogreffe de CSH en 2017 (hémopathies)*
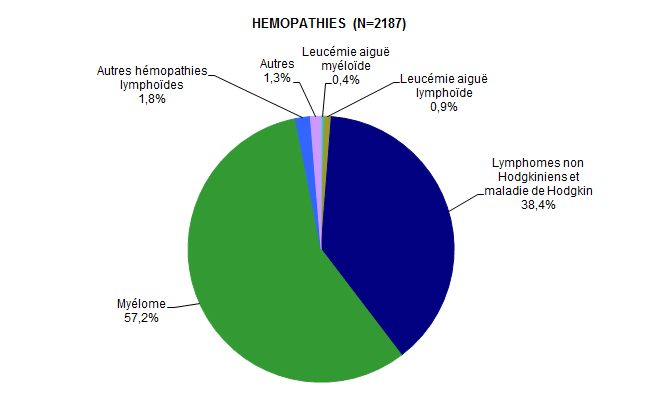
Source : Base ProMISe (extraction du 30 juin 2018)
* Parmi les patients dont les données sont saisies dans ProMISe
Figure CSH G5. Répartition des diagnostics chez les patients ayant eu une autogreffe de CSH en 2017 (tumeurs solides)*
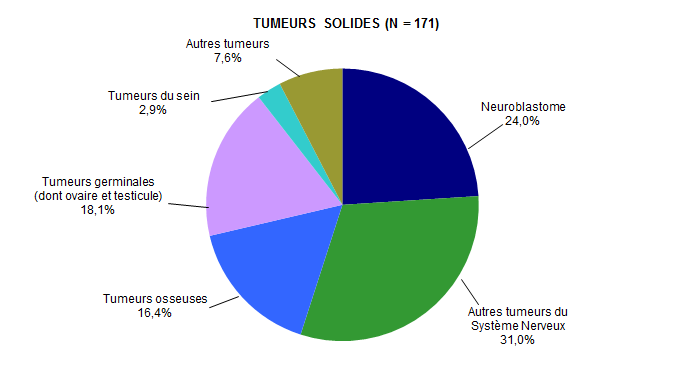
Source : Base ProMISe (extraction du 30 juin 2018)
* Parmi les patients dont les données sont saisies dans ProMISe
Activité d’autogreffe pédiatrique
En 2017, les autogreffes pédiatriques ont été réalisées dans 22 centres pédiatriques ou mixtes (d’après les données saisies dans la base ProMISe). Par ailleurs, les chiffres donnés ci-après sont à interpréter avec prudence car d’une part, 25,5% de l’ensemble des autogreffes 2017 n’ont pas été saisies dans ProMISe et d’autre part, il n’est pas possible de connaître le pourcentage de greffes pédiatriques non saisies dans ProMISe. Néanmoins, les autogreffes pédiatriques restent peu nombreuses (187 autogreffes pédiatriques en 2017, soit 7,5% de la totalité des autogreffes). Les variations interannuelles sont à rapprocher de la mise en place de différents protocoles (exemple : tumeurs cérébrales).
La moyenne d’âge des enfants autogreffés est stable (8 ans). Les Tableaux CSH G4 et CSH G5 donnent la répartition des 143 enfants autogreffés en 2017 selon l’âge et l’indication. Ne sont pas considérées comme des autogreffes les procédures utilisant des prélèvements cellulaires autologues génétiquement modifiés et réinjectés aux patients.
Tableau CSH G4. Répartition des 143 enfants autogreffés en 2017 selon l’âge *
Classe d'âge |
Nombre d'enfants |
0 - 5 ans |
65 |
6 - 10 ans |
27 |
11 - 15 ans |
38 |
16 - 18 ans |
13 |
Total |
143 |
Source : Base ProMISe (extraction du 30 juin 2018)
* Parmi les patients dont les données sont saisies dans ProMISe
Tableau CSH G5. Répartition des 143 enfants autogreffés en 2017 selon l’indication *
Type d'indication |
Nombre d'enfants |
Hémopathies malignes |
19 |
Tumeurs solides |
122 |
Donnée manquante |
2 |
Total |
143 |
Source : Base ProMISe (extraction du 30 juin 2018)
* Parmi les patients dont les données sont saisies dans ProMISe
Activité d’allogreffe globale
En 2017, 1 902 greffes de CSH allogéniques (moelle osseuse, sang périphérique ou sang placentaire) ont été réalisées chez 1 872 patients. Il s’agissait de 904 greffes avec un donneur apparenté et de 998 greffes avec un donneur non apparenté (Tableau CSH G6). 30 patients ont donc reçu en 2017 plus d’une allogreffe de CSH.
L’activité d’allogreffe de CSH, en progression depuis plusieurs années, marque un plateau depuis 2014 (Figure CSH G6), et l’un des facteurs explicatifs prépondérants est une saturation des capacités d’accueil des centres d’allogreffe sur le territoire. De plus, une étude détaillée des conditions de réalisation des greffes dans l’ensemble des centres de greffe a montré que depuis 10 ans, les équipes ont fait face à l’augmentation de l’activité à effectifs quasiment constants.
Les greffes non apparentées, majoritaires depuis 2007, sont passées de 58,2% à 52,5% des allogreffes réalisées entre 2013 et 2017 (Figure CSH G7). C’est le développement des greffes haplo-identiques (375 greffes en 2017, soit 41,5% des greffes apparentées) qui explique l’augmentation progressive du nombre total des greffes apparentées (Figure CSH G6).
Le nombre de greffes dites géno-identiques (donneur identique de la fratrie du patient) est également en baisse constante (de 700 en 2014 à 522 en 2017), ceci étant probablement et au moins en partie dû au vieillissement des patients greffés, et donc de leur fratrie, dans lesquelles les contre-indications au don sont plus fréquentes. Dans ce cas, un donneur alternatif de type haplo-identique est plus souvent utilisé. Cependant, les résultats d’études prospectives comparant les greffes réalisées avec différents types de donneurs alternatifs sont, à ce jour, en attente.
Parmi les greffes non apparentées, la proportion de greffes réalisées à partir d’un donneur adulte volontaire est en progression depuis 2009, tandis que la proportion de greffes réalisées à partir de sang placentaire diminue (Figure CSH G12), le nombre absolu de greffes de sang placentaire non apparentées étant en 2017 de 75 (contre 188 en 2013), Là encore, c’est la part prépondérante des greffes haplo-identiques chez l’adulte qui explique la diminution du recours aux greffes de sang placentaire.
Depuis dix ans, la source principale de greffons allogéniques reste le sang périphérique : 71,8% en 2017 contre 53,6% en 2008. Les greffons médullaires, qui dans un premier temps ont diminué au profit des greffons de CSH issues du sang périphérique, restent stables depuis 2013 (Figure CSH G10).
L’âge moyen des patients allogreffés est en augmentation. Il est de 47 ans en 2017, contre 41 ans en 2012. Si l’on exclut les patients de moins de 18 ans (Figure CSH G9), l’âge moyen en 2017 est de 52 ans contre 48 ans en 2012.
Il est important de noter que 51,2% des patients adultes allogreffés en 2017 ont plus de 55 ans, contre 40,1% en 2012 ; ceci est lié aux progrès en matière de conditionnements qui permettent l’accès à la greffe de patients plus âgés.
Le Tableau CSH G7 rapporte l’activité d’allogreffe telle qu’elle a été déclarée par chaque centre. Dans la colonne centrale est notée l’activité extraite de la base de données ProMISe. En grisé sont indiqués les centres qui ont saisi dans ProMISe moins des trois quarts des greffes réalisées. L’activité d’allogreffe en 2017 se répartit dans 36 centres adultes, pédiatriques, ou mixtes. Le Tableau CSH G8 montre l’activité d’allogreffe de CSH par type de donneur, par source de cellules et par équipe en 2017.
Les indications d’allogreffe sont globalement identiques, que le donneur soit apparenté ou non (Figures CSH G13, CSH G14). Les hémopathies malignes représentent 91,9% des indications de greffe familiale et 94,4% des indications de greffe non apparentée. Les quatre principales indications (Figure CSH G15) restent la leucémie aiguë myéloblastique, la leucémie aiguë lymphoblastique, la myélodysplasie et les lymphomes non Hodgkiniens (respectivement 41,3%, 14,5%, 10,0% et 8,3% des allogreffes en 2017).
Enfin, un total de 319 patients a reçu, après une allogreffe en 2017, des injections de lymphocytes du même donneur (DLI), dans le cadre d’une rechute, d’une perte partielle de greffon ou de façon programmée (Tableau CSH G10). En 2017, le pourcentage de patients allogreffés ayant reçu une ou plusieurs DLI est de 17%. 60,2% de ces patients ont été greffés en situation apparentée et 39,8% en situation non apparentée.
Tableau CSH G6. Activité d’allogreffe de CSH, par type de donneur et d’origine du greffon, en 2017
Allogreffes apparentées |
Allogreffes non apparentées |
Total |
|
Moelle osseuse |
269 |
192 |
461 |
Sang périphérique |
634 |
731 |
1365 |
Sang placentaire |
1 |
75 |
76 |
Total |
904 |
998 |
1902 |
Source : déclarations d’activité des centres de greffe
Figure CSH G6. Evolution du nombre d’allogreffes de CSH selon le type de donneur
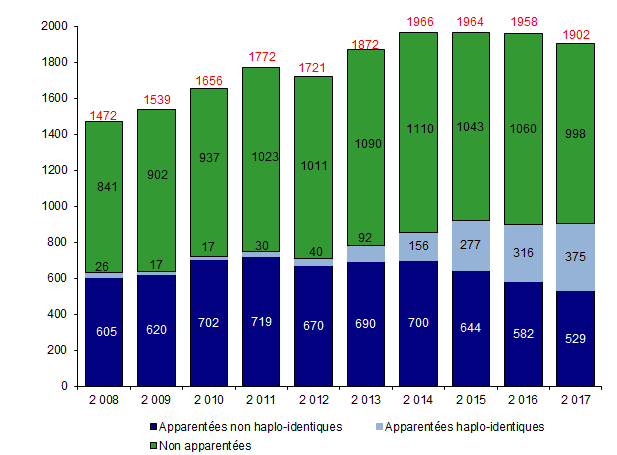
Source : déclarations d’activité des centres de greffe
Figure CSH G7. Evolution du pourcentage d’allogreffes de CSH effectuées à partir d’un greffon issu d’un donneur non apparenté par rapport au nombre total d’allogreffes réalisées
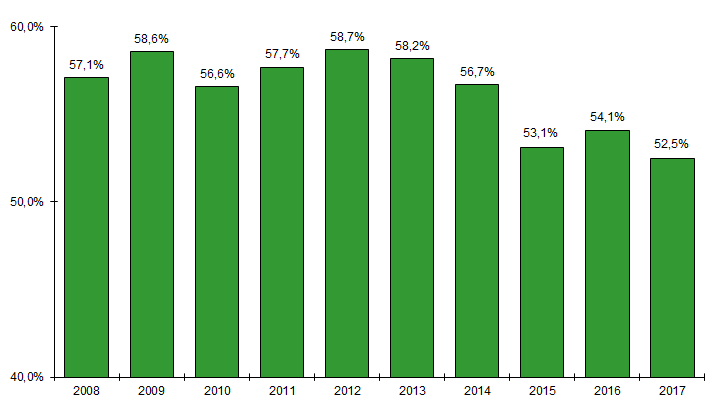
Source : déclarations d’activité des centres de greffe
Figure CSH G8. Répartition des allogreffes de CSH selon le type du donneur
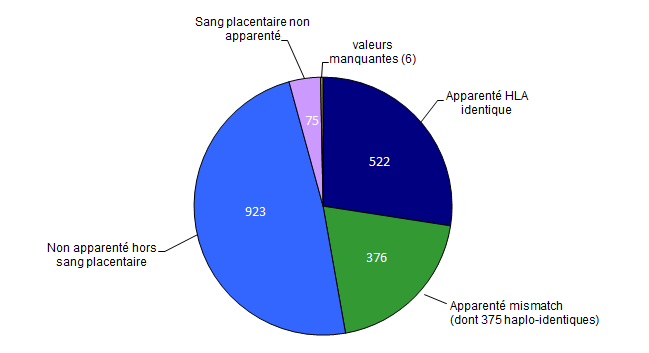
Source : déclarations d’activité des centres de greffe
Figure CSH G9. Evolution de l'âge moyen des patients adultes ayant reçu une allogreffe de CSH
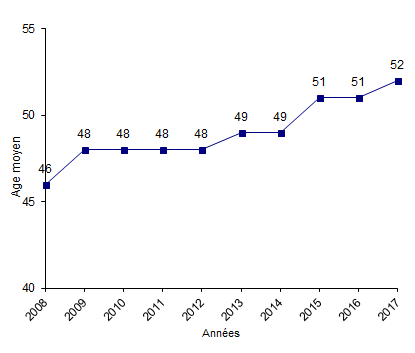
Source : Base ProMISe (extraction du 30 juin 2018)
Figure CSH G10. Evolution de la répartition des sources de greffon de CSH allogéniques
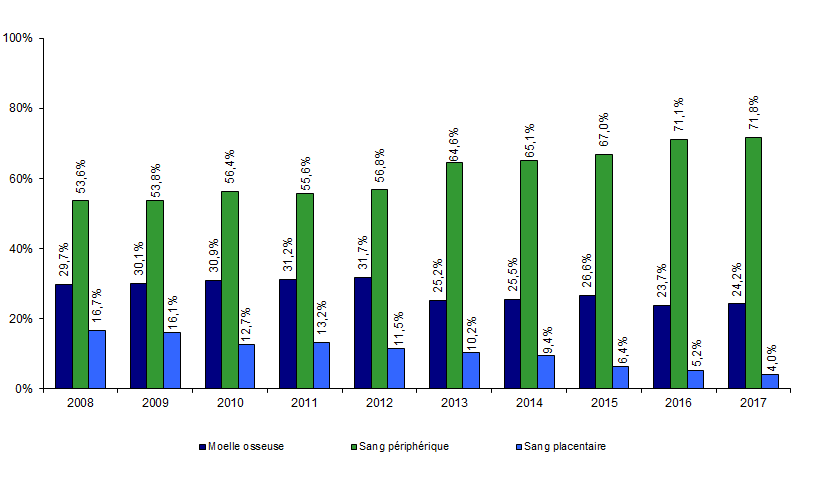
Source : déclarations d’activité des centres de greffe
Figure CSH G11. Evolution de la répartition des sources de greffon de CSH allogéniques apparentées
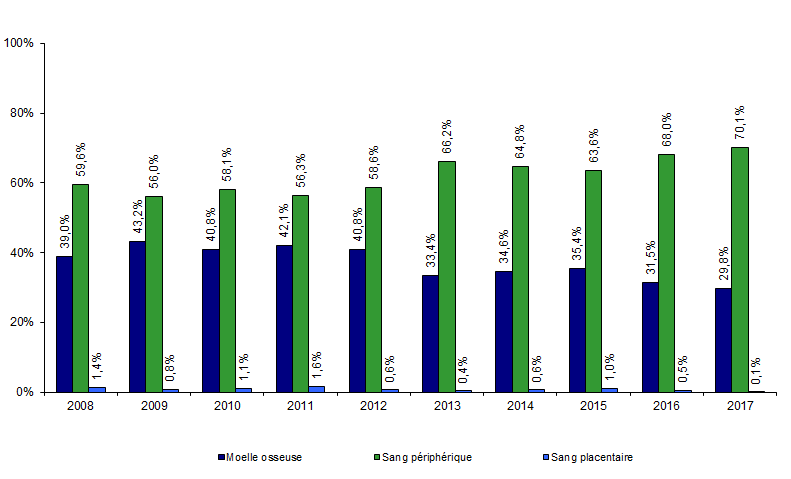
Source : déclarations d’activité des centres de greffe
Figure CSH G12. Evolution de la répartition des sources de greffon de CSH allogéniques non apparentées
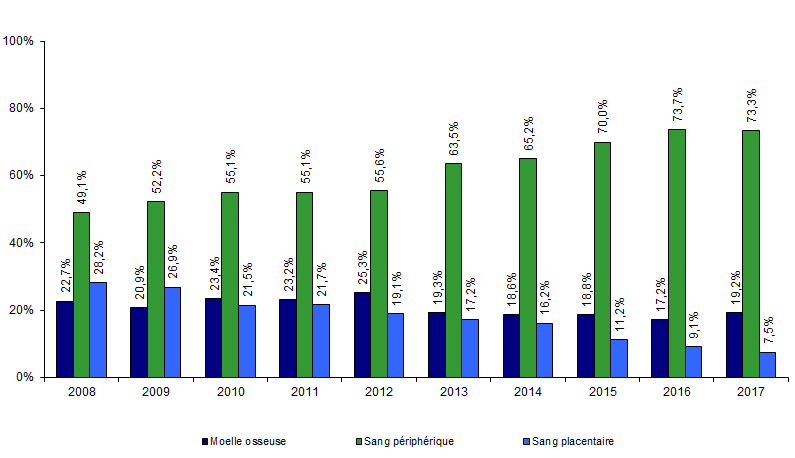
Source : déclarations d’activité des centres de greffe
Tableau CSH G7. Evolution de l'activité d'allogreffe de CSH par équipe
|
Nombre d'allogreffes |
ProMISe |
Nombre de patients |
||||||
2014 |
2015 |
2016 |
2017 |
2017 |
2014 |
2015 |
2016 |
2017 |
|
Amiens Hôpital Sud |
42 |
49 |
49 |
45 |
45 |
42 |
49 |
49 |
43 |
Angers CHU |
33 |
47 |
49 |
32 |
34# |
33 |
47 |
49 |
32 |
Besançon Hôpital Jean Minjoz |
52 |
47 |
47 |
48 |
48 |
50 |
47 |
47 |
48 |
Bordeaux Groupe Hospitalier Pellegrin |
24 |
22 |
27 |
23 |
23 |
24 |
21 |
27 |
23 |
Bordeaux Pessac Hôpital Haut Lévêque |
83 |
86 |
84 |
83 |
83 |
82 |
85 |
82 |
83 |
Brest Hôpital Augustin Morvan |
29 |
25 |
25 |
22 |
22 |
25 |
25 |
24 |
22 |
Caen CHU |
38 |
42 |
43 |
44 |
43 |
38 |
42 |
43 |
45 |
Clamart Hôpital d'Instruction des Armées |
29 |
18 |
28 |
31 |
31 |
29 |
18 |
28 |
31 |
Clermont-Ferrand |
48 |
33 |
43 |
37 |
17 |
48 |
33 |
43 |
36 |
Créteil Hôpital Henri Mondor |
36 |
37 |
40 |
49 |
49 |
35 |
36 |
40 |
49 |
Grenoble CHU |
42 |
45 |
64 |
62 |
62 |
42 |
44 |
63 |
61 |
Lille CHU Claude Huriez |
108 |
95 |
100 |
102 |
102 |
108 |
95 |
100 |
101 |
Lille Hôpital Jeanne de Flandre |
17 |
14 |
12 |
14 |
14 |
17 |
14 |
12 |
13 |
Limoges Centre Hospitalier Dupuytren |
31 |
32 |
35 |
20 |
20 |
30 |
32 |
33 |
20 |
Lyon Centre Hospitalier Lyon Sud |
86 |
84 |
60 |
70 |
69 |
84 |
84 |
58 |
68 |
Lyon Institut d'Hématologie et d'Oncologie Pédiatrique |
33 |
28 |
35 |
29 |
29 |
33 |
28 |
35 |
29 |
Marseille Hôpital de la Timone |
29 |
27 |
36 |
30 |
30 |
27 |
26 |
36 |
30 |
Marseille Institut Paoli Calmettes |
107 |
127 |
152 |
125 |
125 |
106 |
122 |
148 |
120 |
Montpellier Hôpital Saint-Eloi et Hôpital Arnaud de Villeneuve |
103 |
96 |
69 |
69 |
69 |
103 |
94 |
69 |
69 |
Nancy Hôpital d'Enfants |
47 |
44 |
65 |
60 |
58 |
47 |
44 |
63 |
59 |
Nantes Hôtel Dieu |
82 |
111 |
106 |
106 |
106 |
81 |
111 |
105 |
106 |
Nice Hôpital de l'Archet 1 |
52 |
53 |
35 |
37 |
37 |
52 |
53 |
35 |
37 |
Paris Hôpital Necker |
47 |
52 |
46 |
48 |
6 |
42 |
52 |
46 |
45 |
- service d'Hématologie Adulte |
48 |
48 |
49 |
46 |
0 |
48 |
48 |
49 |
46 |
Paris Hôpital Robert Debré |
62 |
58 |
54 |
58 |
50 |
62 |
55 |
54 |
51 |
Paris Hôpital Saint-Antoine |
75 |
72 |
62 |
63 |
64 |
67 |
70 |
60 |
63 |
Paris Hôpital Saint-Louis |
128 |
121 |
130 |
130 |
130 |
126 |
118 |
129 |
130 |
Paris La Pitié Salpetrière |
62 |
67 |
67 |
66 |
66 |
61 |
66 |
65 |
64 |
Poitiers Hôpital Jean Bernard |
34 |
28 |
30 |
34 |
34 |
32 |
28 |
30 |
34 |
Rennes CHU |
62 |
65 |
65 |
52 |
48 |
61 |
65 |
65 |
51 |
Rouen Centre Henri Becquerel |
31 |
25 |
36 |
25 |
25 |
31 |
25 |
36 |
25 |
Rouen Hôpital Charles Nicolle |
8 |
7 |
11 |
7 |
7 |
8 |
7 |
10 |
7 |
Saint-Étienne Institut de Cancérologie |
63 |
28 |
27 |
31 |
31 |
40 |
28 |
27 |
31 |
Strasbourg Hôpital de Hautepierre |
65 |
67 |
50 |
62 |
57 |
65 |
67 |
50 |
60 |
Toulouse Oncopôle |
55 |
68 |
55 |
64 |
65 |
55 |
66 |
55 |
62 |
Tours Hôpital Bretonneau |
13 |
16 |
1 |
0 |
0 |
13 |
12 |
1 |
0 |
Villejuif Institut Gustave Roussy |
62 |
80 |
71 |
78 |
78 |
61 |
79 |
69 |
78 |
Total |
1966 |
1964 |
1958 |
1902 |
1777 |
1908 |
1936 |
1935 |
1872 |
# Nombre d’allogreffes saisies supérieur au nombre déclaré
En gris : Centre ayant saisi moins des trois quarts des greffes réalisées
Source : déclarations d’activité des centres de greffe
Tableau CSH G8. Activité d'allogreffe de CSH par type de donneur, par source de cellules et par équipe en 2017*
|
Moelle osseuse |
Sang périphérique |
Sang placentaire |
Total |
|||
apparentée |
non |
apparentée |
non |
apparentée |
non |
||
Amiens Hôpital Sud |
3 |
2 |
13 |
27 |
0 |
0 |
45 |
Angers CHU : |
2 |
4 |
15 |
11 |
0 |
0 |
32 |
Besançon Hôpital Jean Minjoz |
0 |
3 |
21 |
23 |
0 |
1 |
48 |
Bordeaux Groupe Hospitalier Pellegrin |
9 |
6 |
0 |
0 |
0 |
8 |
23 |
Bordeaux Pessac |
1 |
0 |
30 |
43 |
0 |
9 |
83 |
Brest Hôpital Augustin Morvan |
0 |
5 |
8 |
9 |
0 |
0 |
22 |
Caen CHU |
9 |
1 |
11 |
22 |
0 |
1 |
44 |
Clamart Hôpital d'Instruction des Armées |
1 |
1 |
16 |
11 |
0 |
2 |
31 |
Clermont-Ferrand |
1 |
0 |
11 |
24 |
0 |
1 |
37 |
Créteil Hôpital Henri Mondor |
3 |
6 |
16 |
24 |
0 |
0 |
49 |
Grenoble CHU |
4 |
7 |
18 |
32 |
0 |
1 |
62 |
Lille CHU Claude Huriez |
25 |
30 |
23 |
24 |
0 |
0 |
102 |
Lille Hôpital Jeanne de Flandre |
6 |
4 |
0 |
2 |
0 |
2 |
14 |
Limoges Centre Hospitalier Dupuytren |
0 |
1 |
12 |
7 |
0 |
0 |
20 |
Lyon Centre Hospitalier Lyon Sud |
16 |
8 |
12 |
34 |
0 |
0 |
70 |
Lyon Institut d'Hématologie et d'Oncologie Pédiatrique |
8 |
13 |
1 |
2 |
0 |
5 |
29 |
Marseille Hôpital de la Timone : |
10 |
9 |
1 |
0 |
0 |
10 |
30 |
Marseille Institut Paoli Calmettes |
3 |
4 |
75 |
43 |
0 |
0 |
125 |
Montpellier Hôpital Saint-Eloi et Hôpital Arnaud de Villeneuve |
8 |
3 |
24 |
32 |
0 |
2 |
69 |
Nancy Hôpital d'Enfants |
1 |
8 |
17 |
27 |
0 |
7 |
60 |
Nantes Hôtel Dieu |
11 |
6 |
46 |
37 |
0 |
6 |
106 |
Nice Hôpital de l'Archet 1 |
4 |
2 |
12 |
18 |
0 |
1 |
37 |
Paris Hôpital Necker : |
29 |
13 |
2 |
4 |
0 |
0 |
48 |
- service d'Hématologie Adulte |
3 |
0 |
18 |
25 |
0 |
0 |
46 |
Paris Hôpital Robert Debré |
30 |
22 |
1 |
0 |
1 |
4 |
58 |
Paris Hôpital Saint-Antoine |
4 |
0 |
44 |
14 |
0 |
1 |
63 |
Paris Hôpital Saint-Louis : |
17 |
7 |
41 |
64 |
0 |
1 |
130 |
Paris La Pitié Salpetrière : |
16 |
1 |
24 |
24 |
0 |
1 |
66 |
Poitiers Hôpital Jean Bernard |
7 |
1 |
5 |
20 |
0 |
1 |
34 |
Rennes CHU |
10 |
7 |
16 |
17 |
0 |
2 |
52 |
Rouen Centre Henri Becquerel |
1 |
1 |
6 |
17 |
0 |
0 |
25 |
Rouen Hôpital Charles Nicolle |
0 |
6 |
0 |
0 |
0 |
1 |
7 |
Saint-Étienne Institut de Cancérologie |
7 |
1 |
5 |
16 |
0 |
2 |
31 |
Strasbourg Hôpital de Hautepierre |
10 |
5 |
25 |
19 |
0 |
3 |
62 |
Toulouse Oncopôle |
8 |
3 |
24 |
27 |
0 |
2 |
64 |
Villejuif Institut Gustave Roussy : |
2 |
2 |
41 |
32 |
0 |
1 |
78 |
Total |
269 |
192 |
634 |
731 |
1 |
75 |
1902 |
Source : déclarations d’activité des centres de greffe
* voir paragraphe « matériel et méthodes – contrôle qualité »
Tableau CSH G9. Evolution de l’activité d’allogreffe de CSH au niveau des schémas interrégionaux d’organisation sanitaire (SIOS)
|
Nombre d'allogreffes |
Nombre de patients |
||||||||
|
2013 |
2014 |
2015 |
2016 |
2017 |
2013 |
2014 |
2015 |
2016 |
2017 |
SIOS Nord-Ouest |
214 |
244 |
232 |
251 |
237 |
214 |
244 |
232 |
250 |
234 |
SIOS Ouest |
257 |
253 |
292 |
276 |
246 |
257 |
245 |
288 |
274 |
245 |
SIOS Sud-Ouest |
178 |
193 |
208 |
201 |
190 |
176 |
191 |
204 |
197 |
188 |
SIOS Est |
146 |
164 |
158 |
162 |
170 |
144 |
162 |
158 |
160 |
167 |
SIOS Sud-Est |
235 |
272 |
218 |
229 |
229 |
231 |
247 |
217 |
226 |
225 |
SIOS Sud-Méditerranée |
301 |
291 |
303 |
292 |
261 |
298 |
288 |
295 |
288 |
256 |
SROS Ile de France |
541 |
549 |
553 |
547 |
569 |
526 |
531 |
542 |
540 |
557 |
France |
1872 |
1966 |
1964 |
1958 |
1902 |
1846 |
1908 |
1936 |
1935 |
1872 |
Source : déclarations d’activité des centres de greffe
Figure CSH G13. Répartition des indications en 2017 des allogreffes apparentées (n=835 patients)*
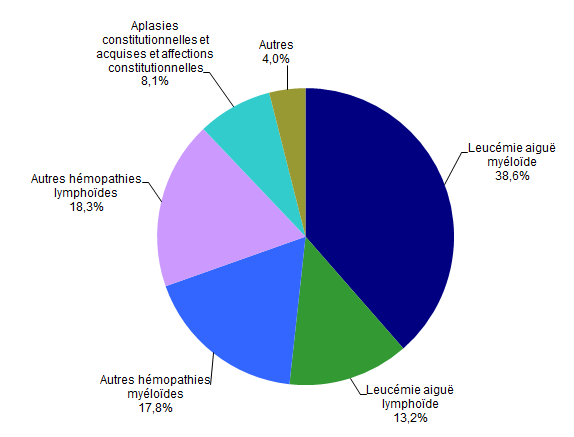
Source : Base ProMISe (extraction du 30 juin 2018)
* Parmi les patients dont les données sont saisies dans ProMISe
Figure CSH G14. Répartition des indications en 2017 des allogreffes non apparentées (n=923 patients) *
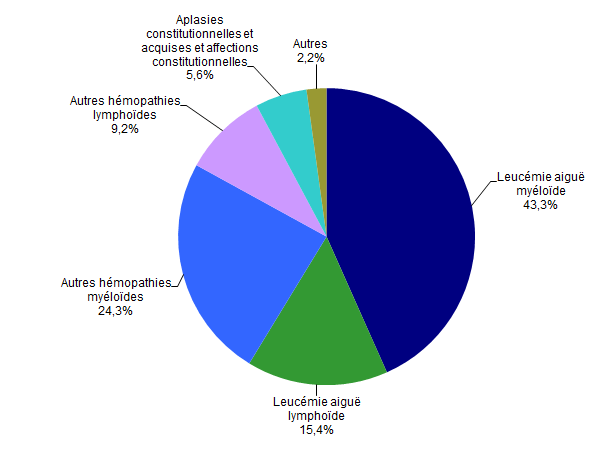
Source : Base ProMISe (extraction du 30 juin 2018)
* Parmi les patients dont les données sont saisies dans ProMISe
Figure CSH G15. Evolution de la répartition des indications d’allogreffe*
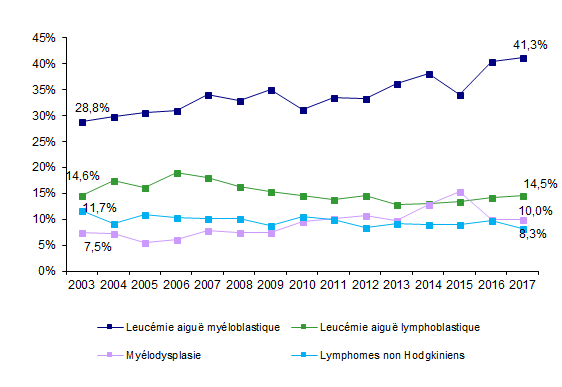
Source : Base ProMISe (extraction du 30 juin 2018)
* Parmi les patients dont les données sont saisies dans ProMISe
Tableau CSH G10. Injections de lymphocytes du donneur (DLI) en 2017
Nombre de patients ayant eu |
Nombre de patients ayant eu |
Total |
||
De façon programmée |
De façon non programmée (rechute, perte partielle de greffon) |
De façon programmée |
De façon non programmée (rechute, perte partielle de greffon) |
|
42 |
150 |
21 |
106 |
319 |
Source : déclarations d’activité des centres de greffe
Activité d’allogreffe pédiatrique
Le nombre absolu d’allogreffes pédiatriques est globalement stable depuis 10 ans (Figure CSH G16). Cette activité a été évaluée sur les 1 777 allogreffes 2017 saisies dans ProMISe : 229 allogreffes de CSH ont été rapportées pour 224 patients de moins de 18 ans dans 20 centres. La part de la pédiatrie a diminué en valeur relative, en raison de l’augmentation du nombre d’allogreffes réalisées chez des adultes.
La part des maladies malignes dans les indications d’allogreffe chez les receveurs de moins de 18 ans (Figure CSH G17) représente 67,8% en 2017. La proportion de maladies malignes est plus importante pour les deux classes d’âge les plus élevées. L’incidence de la prise en charge croissante des syndromes drépanocytaires majeurs, en France dans des réseaux organisés, n’a pas donné lieu à un surcroît significatif d’indications d’allogreffes pédiatriques.
La proportion de greffons issus de la moelle osseuse est, chez les receveurs mineurs, toujours majoritaire (75%) et plus élevée que dans la population générale (24,2%) en raison d’indications et de conditionnements différents de ceux des patients adultes. La part des greffes de sang placentaire (19,7%) reste plus élevée que dans la population générale (4,0%) (Tableau CSH G11).
Figure CSH G16. Nombre d’allogreffes de CSH pédiatriques depuis 2008
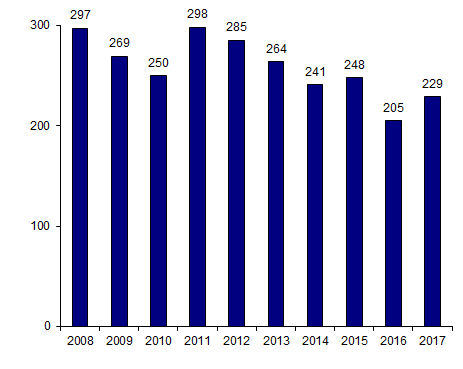
Source : Base ProMISe (extraction du 30 juin 2018)
Figure CSH G17. Proportion de maladies malignes en fonction de l’âge chez les 224 patients de moins de 18 ans ayant reçu une allogreffe en 2017
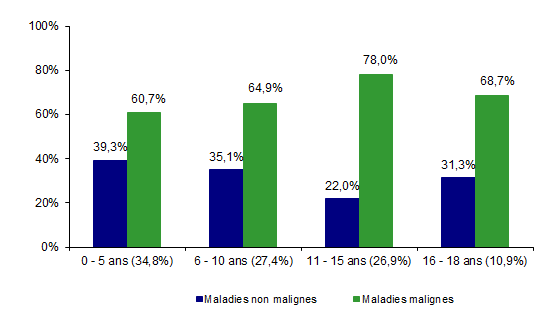
Source : Base ProMISe (extraction du 30 juin 2018)
Tableau CSH G11. Nombre d’allogreffes apparentées et non apparentées selon l’origine des CSH et le type de maladie chez les patients de moins de 18 ans, en 2017
|
Moelle osseuse |
Sang périphérique |
Sang placentaire |
Total |
|||
Apparenté |
Non apparenté |
Apparenté |
Non apparenté |
Apparenté |
Non apparenté |
||
Maladies malignes |
45 |
60 |
6 |
4 |
1 |
32 |
148 |
Maladies non malignes |
41 |
21 |
1 |
1 |
1 |
10 |
75 |
Total |
86 |
81 |
7 |
5 |
2 |
42 |
223* |
* six greffes avec type de donneur non saisi
Source : Base ProMISe (extraction du 30 juin 2018)
Conclusion
L’évolution de l’activité d’allogreffe depuis 5 ans montre une part croissante de l’activité de greffe haplo-identique, avec, chez l’adulte, une diminution progressive des greffes de sang placentaire.
Devant cette évolution récente, les études prospectives nationales et internationales comparant les résultats des greffes avec différentes sources de greffons alternatifs sont attendues par la communauté des greffeurs afin de toujours mieux adapter à chaque patient, parmi un choix plus diversifié, la stratégie de greffe qui lui convient.
L’activité pédiatrique reste remarquablement stable depuis 10 ans, avec de nombreuses indications de greffe de sang placentaire persistantes, du fait d’excellents résultats publiés par les équipes françaises notamment.
L’activité d’autogreffe est globalement stable avec une majorité d’hémopathies malignes, parmi lesquelles le myélome reste prépondérant.
Etude de la survie des patients après allogreffe de cellules souches hématopoïétiques
Guide d’interprétation
La cohorte de base choisie pour cette étude est celle des quinze dernières années : 2003-2017.
Pour chaque courbe de survie, la largeur de la figure (échelle de l’axe des abscisses) représente le recul maximum théorique que l’on peut avoir pour un patient, compte tenu de la cohorte choisie.
La courbe de survie s’arrête soit au temps correspondant au dernier évènement (patient décédé) de la cohorte, soit lorsqu’il n’y a plus assez de sujets encore à risque (patients non décédés) pour pouvoir calculer un taux de survie. Par exemple, si le dernier évènement de la cohorte survient juste avant 5 ans, la courbe s’arrêtera avant 5 ans. Mais la survie à 5 ans peut quand même être calculée s’il y a encore à cette date assez de sujets à risque (elle figure dans le tableau sous la courbe de survie). En revanche, lorsque le taux de survie à 5 ans est « NO » (Non Observable) dans le tableau en dessous de la courbe, cela signifie qu’il ne reste pas assez de sujets encore à risque à 5 ans pour calculer un taux de survie.
Par ailleurs, le nombre de sujets encore à risque nécessaire pour estimer un taux de survie a été calculé, selon les recommandations de Pocock (The Lancet, vol. 359, 2002), comme un pourcentage du nombre de sujets inclus dans la cohorte. Pour un même graphique, ce pourcentage est identique pour toutes les strates sur lesquelles on estime une courbe de survie. Nous avons choisi, dans ce rapport, un pourcentage de 15% pour tous les graphiques.
Etude globale selon la période de greffe
L’amélioration constante des techniques de greffe et de soins de support pour les patients allogreffés ont entraîné une amélioration de la survie globale post-greffe : toutes les cohortes ci-dessous montrent une survie supérieure à celle de 1995-2002 (non représentée).
Un effet période, avec une amélioration significative de la survie des patients greffés de 2010 à 2017 comparativement à ceux greffés de 2003 à 2009, est également observé, que ce soit dans la population générale des patients allogreffés (Figure CSH G18), chez les patients allogreffés pour leucémie aiguë (Figure CSH G19) ou chez ceux greffés pour aplasie médullaire (Figure CSH G20).
Figure CSH G18. Survie des patients après allogreffe de CSH selon la période (cohorte 2003-2017)
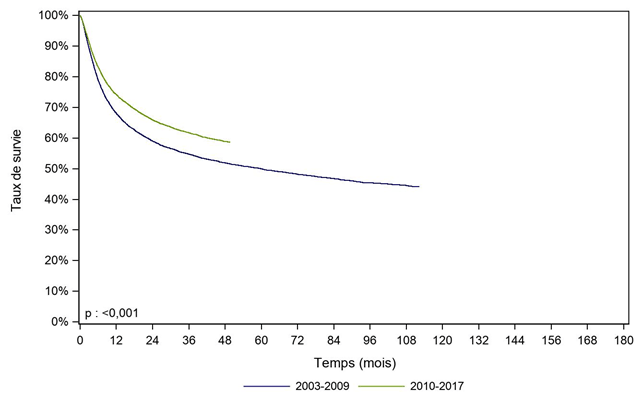
période |
N |
Survie à 1 an |
Survie à 2 ans |
Survie à 5 ans |
Médiane de |
2003-2009 |
8193 |
68,1% |
59,0% |
50,0% |
59,9 |
nombre de sujets à risque* |
|
5477 |
4613 |
3034 |
|
2010-2017 |
13434 |
74,1% |
65,9% |
NO |
NO |
nombre de sujets à risque* |
|
7552 |
4734 |
1311 |
|
[] : Intervalle de confiance
NO : non observable
* : Nombre de malades restant à observer pour chaque temps et pour lesquels aucun évènement n'est survenu
Figure CSH G19. Survie des patients après allogreffe pour leucémie aiguë myéloïde ou leucémie aiguë lymphoïde, selon la période (cohorte 2003-2017)
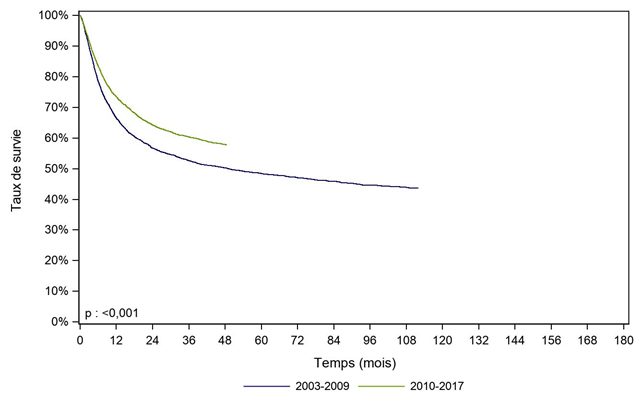
période |
N |
Survie à 1 an |
Survie à 2 ans |
Survie à 5 ans |
Médiane de |
2003-2009 |
4067 |
66,6% |
56,7% |
48,4% |
49,0 |
nombre de sujets à risque* |
|
2677 |
2225 |
1507 |
|
2010-2017 |
6782 |
73,5% |
64,3% |
NO |
NO |
nombre de sujets à risque* |
|
3739 |
2284 |
618 |
|
[] : Intervalle de confiance
NO : non observable
* : Nombre de malades restant à observer pour chaque temps et pour lesquels aucun évènement n'est survenu
Figure CSH G20. Survie des patients après allogreffe pour aplasie médullaire, selon la période (cohorte 2003-2017)
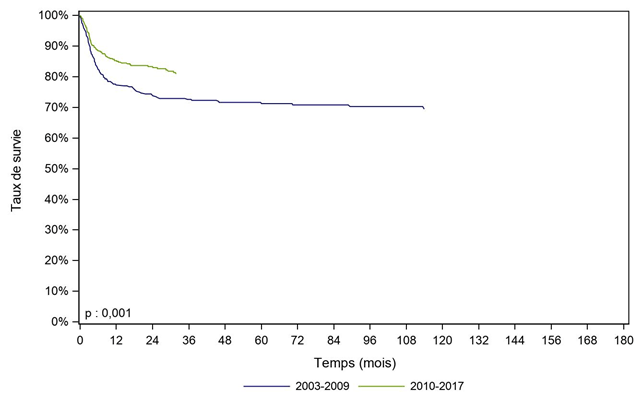
période |
N |
Survie à 1 an |
Survie à 2 ans |
Survie à 5 ans |
Médiane de |
2003-2009 |
358 |
77,3% |
74,1% |
71,6% |
NO |
nombre de sujets à risque* |
|
269 |
250 |
186 |
|
2010-2017 |
578 |
85,2% |
83,3% |
NO |
NO |
nombre de sujets à risque* |
|
352 |
239 |
71 |
|
[] : Intervalle de confiance
NO : non observable
* : Nombre de malades restant à observer pour chaque temps et pour lesquels aucun évènement n'est survenu
Etude de la survie des patients adultes allogreffés pour leucémie aiguë myéloïde ou lymphoïde uniquement en première rémission complète
Dans les figures suivantes, le degré de disparité HLA des donneurs non apparentés n’a pas été pris en compte : les différences de survie globale observées entre les patients adultes greffés pour leucémie aiguë myéloïde en situation non apparentée (9/10 ou 10/10) et en situation apparentée 10/10 sont donc à interpréter avec prudence (Figure CSH G21).
Alors que les patients greffés pour LAM avec des CSH issues du sang placentaire ont une survie globale plus faible (Figure CSH G21), le type de greffon n’a pas d’impact sur la survie des patients atteints de leucémie aiguë lymphoïde (Figure CSH G22).
L’utilisation des allogreffes haplo-identiques chez les patients adultes présentant une LAM ou une LAL est trop récente pour que leur impact soit étudié sur l’ensemble des indications : à ce jour, seule la cohorte de patients adultes ayant reçu une allogreffe haplo-identique pour une leucémie aiguë myéloïde s’avère suffisante pour présenter un premier résultat en termes de survie à 2 ans (Figure CSH G21).
Figure CSH G21. Survie des patients adultes après allogreffe pour leucémie aiguë myéloïde en première rémission complète, selon le type de donneur (cohorte 2003-2017)
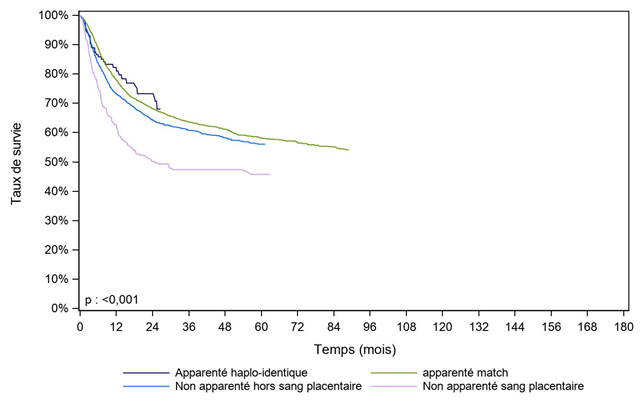
Type de donneur |
N |
Survie à 1 an |
Survie à 2 ans |
Survie à 5 ans |
Médiane de |
Apparenté haplo-identique |
159 |
82,2% |
73,3% |
NO |
NO |
nombre de sujets à risque* |
|
66 |
30 |
1 |
|
apparenté match |
1885 |
78,0% |
68,2% |
58,2% |
NO |
nombre de sujets à risque* |
|
1290 |
966 |
499 |
|
Non apparenté hors sang placentaire |
1971 |
73,3% |
64,4% |
56,1% |
NO |
nombre de sujets à risque* |
|
1179 |
789 |
314 |
|
Non apparenté sang placentaire |
283 |
62,7% |
50,2% |
45,8% |
24,7 |
nombre de sujets à risque* |
|
161 |
115 |
53 |
|
[] : Intervalle de confiance
NO : non observable
* : Nombre de malades restant à observer pour chaque temps et pour lesquels aucun évènement n'est survenu
Figure CSH G22. Survie des patients adultes après allogreffe pour leucémie aiguë lymphoïde en première rémission complète, selon le type de donneur (cohorte 2003-2017)
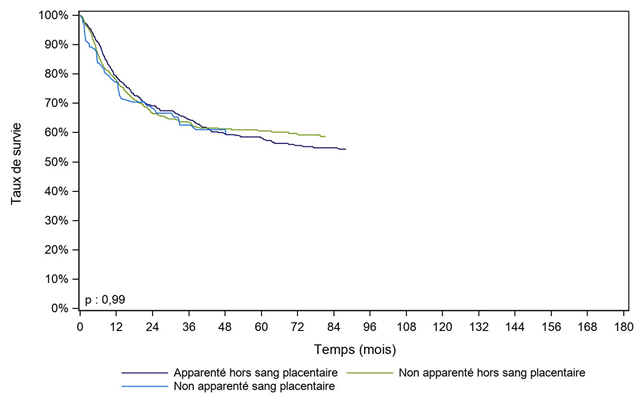
Type de donneur |
N |
Survie à 1 an |
Survie à 2 ans |
Survie à 5 ans |
Médiane de |
Apparenté hors sang placentaire |
730 |
79,2% |
69,2% |
58,2% |
NO |
nombre de sujets à risque* |
|
504 |
375 |
192 |
|
Non apparenté hors sang placentaire |
684 |
78,0% |
66,7% |
60,6% |
NO |
nombre de sujets à risque* |
|
457 |
316 |
156 |
|
Non apparenté sang placentaire |
93 |
77,2% |
69,2% |
59,4% |
NO |
nombre de sujets à risque* |
|
70 |
54 |
29 |
|
[] : Intervalle de confiance
NO : non observable
* : Nombre de malades restant à observer pour chaque temps et pour lesquels aucun évènement n'est survenu
Etude de la survie des enfants allogreffés pour leucémie aiguë myéloïde ou lymphoïde en rémission complète
Les courbes de survie des enfants allogreffés avec des CSH apparentées ou non apparentées montrent des différences significatives, mais sont à interpréter avec prudence du fait de l’hétérogénéité des facteurs pronostiques avant greffe chez ces patients, non pris en compte dans ces figures en raison d’un effectif trop faible, dont notamment le statut de rémission (1ère RC ou au-delà) (Figure CSH G23, Figure CSH G24).
Figure CSH G23. Survie des enfants après allogreffe pour leucémie aiguë myéloïde en rémission complète, selon le type de donneur (cohorte 2003-2017)
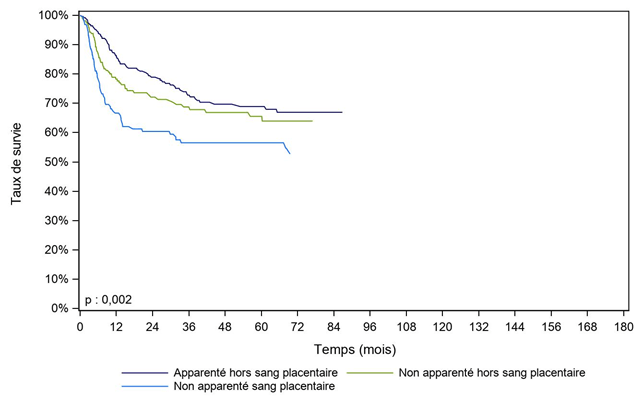
Type de donneur |
N |
Survie à 1 an |
Survie à 2 ans |
Survie à 5 ans |
Médiane de |
Apparenté hors sang placentaire |
258 |
86,3% |
78,9% |
68,9% |
NO |
nombre de sujets à risque* |
|
186 |
152 |
78 |
|
Non apparenté hors sang placentaire |
214 |
78,3% |
72,1% |
65,5% |
NO |
nombre de sujets à risque* |
|
129 |
94 |
43 |
|
Non apparenté sang placentaire |
159 |
66,7% |
60,4% |
56,6% |
NO |
nombre de sujets à risque* |
|
90 |
71 |
34 |
|
[] : Intervalle de confiance
NO : non observable
* : Nombre de malades restant à observer pour chaque temps et pour lesquels aucun évènement n'est survenu
Figure CSH G24. Survie des enfants après allogreffe pour leucémie aiguë lymphoïde en rémission complète, selon le type de donneur (cohorte 2003-2017)
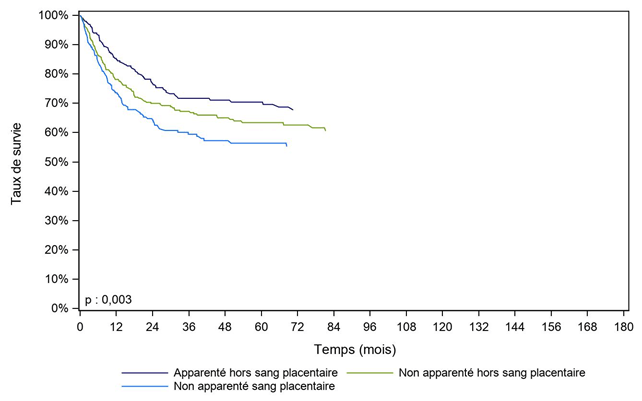
Type de donneur |
N |
Survie à 1 an |
Survie à 2 ans |
Survie à 5 ans |
Médiane de |
Apparenté hors sang placentaire |
295 |
85,3% |
76,8% |
70,4% |
NO |
nombre de sujets à risque* |
|
204 |
161 |
92 |
|
Non apparenté hors sang placentaire |
403 |
78,1% |
70,0% |
63,4% |
NO |
nombre de sujets à risque* |
|
251 |
192 |
92 |
|
Non apparenté sang placentaire |
271 |
73,6% |
64,8% |
56,4% |
NO |
nombre de sujets à risque* |
|
163 |
115 |
54 |
|
[] : Intervalle de confiance
NO : non observable
* : Nombre de malades restant à observer pour chaque temps et pour lesquels aucun évènement n'est survenu
Etude de la survie des patients (adultes ou enfants) allogreffés pour aplasie médullaire selon l’origine (acquise ou constitutionnelle)
En raison du faible effectif des patients allogreffés pour aplasie médullaire, les figures suivantes (Figure CSH G25, Figure CSH G26) ont été réalisées à partir d’une cohorte large (2003-2017) et sans distinguer enfants et adultes.
La courbe de survie des patients greffés avec des donneurs non apparentés ne prend pas en compte les disparités HLA (9/10 versus 10/10).
Il faut noter cependant que la greffe apparentée peut être réalisée dans les semaines qui suivent le diagnostic pour ces patients, si un tel donneur est disponible, alors que les greffes non apparentées sont réalisées chez des patients plus avancés, généralement après échec du traitement initial de 1ère ligne.
Les patients des cohortes apparentées et non apparentées ne sont donc pas comparables, ni en ce qui concerne l’état d’avancement de la maladie, ni sur les traitements reçus avant la greffe.
Parmi les allogreffes non apparentées, en dépit des faibles effectifs, il a été possible de distinguer les allogreffes issues de donneurs non apparentés adultes et celles issues de sang placentaire non apparenté. On observe une différence significative défavorable pour le sang placentaire non apparenté.
Ces résultats, obtenus sur une cohorte de patients hétérogènes en termes d’année de greffe, d’âge, de richesse cellulaire du greffon de sang placentaire et de conditionnements, sont à prendre avec beaucoup de précautions : en effet une étude prospective nationale très récente montre une nette amélioration de la survie globale post-greffe de sang placentaire, pour aplasie médullaire réfractaire, chez des patients jeunes sans donneur adulte non apparenté.
Figure CSH G25. Survie des patients après allogreffe pour aplasie médullaire acquise, selon le type de donneur (cohorte 2003-2017)
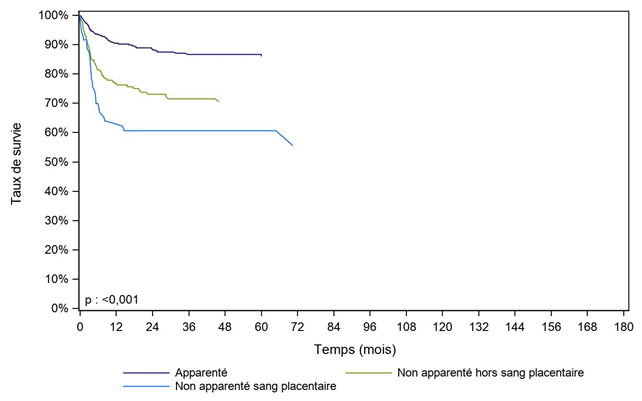
Type de donneur |
N |
Survie à 1 an |
Survie à 2 ans |
Survie à 5 ans |
Médiane de |
Apparenté |
418 |
90,5% |
88,6% |
86,7% |
NO |
nombre de sujets à risque* |
|
304 |
250 |
134 |
|
Non apparenté hors sang placentaire |
218 |
76,8% |
73,1% |
70,6% |
NO |
nombre de sujets à risque* |
|
140 |
104 |
57 |
|
Non apparenté sang placentaire |
72 |
63,9% |
60,7% |
60,7% |
NO |
nombre de sujets à risque* |
|
40 |
33 |
14 |
|
[] : Intervalle de confiance
NO : non observable
* : Nombre de malades restant à observer pour chaque temps et pour lesquels aucun évènement n'est survenu
Figure CSH G26. Survie des patients après allogreffe pour aplasie médullaire constitutionnelle, selon le type de donneur (cohorte 2003-2017)
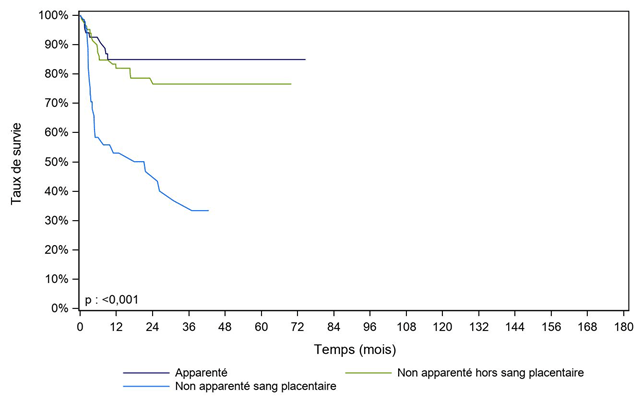
Type de donneur |
N |
Survie à 1 an |
Survie à 2 ans |
Survie à 5 ans |
Médiane de |
Apparenté |
68 |
84,9% |
84,9% |
84,9% |
NO |
nombre de sujets à risque* |
|
43 |
32 |
16 |
|
Non apparenté hors sang placentaire |
84 |
81,9% |
78,6% |
76,6% |
NO |
nombre de sujets à risque* |
|
56 |
39 |
21 |
|
Non apparenté sang placentaire |
46 |
53,0% |
46,8% |
NO |
21,6 |
nombre de sujets à risque* |
|
19 |
14 |
7 |
|
[] : Intervalle de confiance
NO : non observable
* : Nombre de malades restant à observer pour chaque temps et pour lesquels aucun évènement n'est survenu
Etude de la survie des patients (adultes ou enfants) allogreffés pour lymphome ou myélome
Lorsque le diagnostic est un lymphome ou un myélome (Figure CSH G27, Figure CSH G28), les patients ayant reçu une allogreffe avec un donneur apparenté ont une meilleure survie que les autres patients (donneur non apparenté ou sang placentaire non apparenté).
On remarque également un effet période : la survie est meilleure pour les patients allogreffés entre 2010 et 2017 que pour les patients allogreffés entre 2003 et 2009. Ceci est à rapprocher de l’utilisation de nouvelles molécules en complément de la greffe, et de l’évolution générale des stratégies de greffe pour ces patients.
Figure CSH G27. Survie des patients après allogreffe pour lymphome (cohorte 2003-2017)
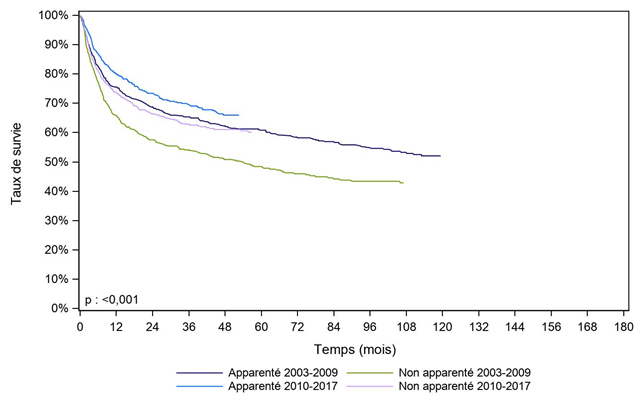
Type de donneur |
N |
Survie à 1 an |
Survie à 2 ans |
Survie à 5 ans |
Médiane de |
Apparenté 2003-2009 |
606 |
75,6% |
68,8% |
60,8% |
NO |
nombre de sujets à risque* |
|
443 |
391 |
271 |
|
Non apparenté 2003-2009 |
497 |
66,0% |
57,5% |
48,4% |
54,0 |
nombre de sujets à risque* |
|
321 |
277 |
167 |
|
Apparenté 2010-2017 |
835 |
80,1% |
73,4% |
NO |
NO |
nombre de sujets à risque* |
|
523 |
346 |
95 |
|
Non apparenté 2010-2017 |
810 |
73,7% |
66,4% |
NO |
NO |
nombre de sujets à risque* |
|
487 |
333 |
100 |
|
[] : Intervalle de confiance
NO : non observable
* : Nombre de malades restant à observer pour chaque temps et pour lesquels aucun évènement n'est survenu
Figure CSH G28. Survie des patients après allogreffe pour myélome (cohorte 2003-2017)
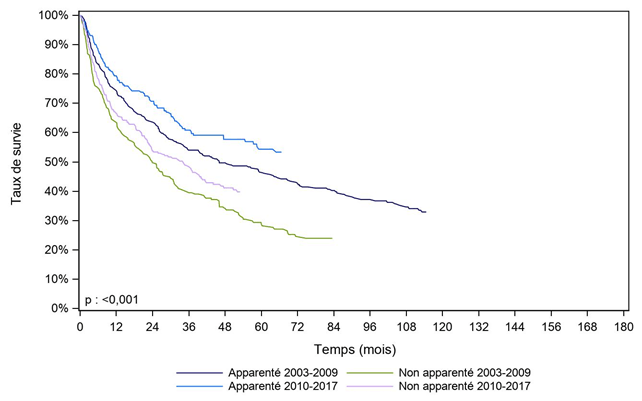
Type de donneur |
N |
Survie à 1 an |
Survie à 2 ans |
Survie à 5 ans |
Médiane de |
Apparenté 2003-2009 |
332 |
74,5% |
63,9% |
46,5% |
46,1 |
nombre de sujets à risque* |
|
240 |
204 |
125 |
|
Non apparenté 2003-2009 |
229 |
63,8% |
49,8% |
28,8% |
23,9 |
nombre de sujets à risque* |
|
146 |
114 |
51 |
|
Apparenté 2010-2017 |
305 |
79,4% |
70,7% |
54,4% |
NO |
nombre de sujets à risque* |
|
213 |
157 |
60 |
|
Non apparenté 2010-2017 |
361 |
66,5% |
53,8% |
NO |
34,1 |
nombre de sujets à risque* |
|
204 |
135 |
47 |
|
[] : Intervalle de confiance
NO : non observable
* : Nombre de malades restant à observer pour chaque temps et pour lesquels aucun évènement n'est survenu