Introduction
La surveillance de la sécurité et de la qualité des actes d’assistance médicale à la procréation (AMP) est une préoccupation constante pour les professionnels concernés par ces activités et pour les autorités de santé et tout particulièrement l’Agence de la biomédecine. Diverses mesures de prévention sont mises en œuvre en amont pour tendre à la minimisation des risques (ex : prévention des risques liés au geste clinique par la délivrance d’autorisation de sites, programme d’inspection, formation du personnel, prévention des risques liés aux voyages du donneur ou du couple par la mise en œuvre de recommandations/exigences concernant leur éviction ou leur dépistage, etc.…). Néanmoins, la surveillance de l’équilibre bénéfices/risques, quel que soit l’acte d’AMP, repose essentiellement sur l’analyse des déclarations des professionnels de santé réceptionnées au fil de l’eau ainsi que sur les données épidémiologiques issues de la surveillance de populations cibles (ex : donneuses de gamètes, enfants issus d’un acte d’AMP, …). L’apport des données épidémiologiques, à l’instar de la pharmaco-épidémiologie, palie à la fois le risque de sous-notification, la difficulté d’identification des signaux faibles (ceux pour lesquels l’imputabilité des gamètes/embryons/tissus germinaux ou de l’acte d’AMP n’est pas certaine) et l’absence de possibilité de quantification du risque (liée pour partie à la sous-notification).
C’est cette « AMP-surveillance » dont la mise en place se fera progressivement qui constitue le nouveau cadre d’une vigilance modernisée ayant pour objet la détection, l’évaluation et la quantification des risques liés à l’usage des gamètes/embryons/tissus germinaux en tenant compte de toutes les données exploitables : caractéristiques des produits issus du corps humain, indications de l’acte, déclarations spontanées, études épidémiologiques, données de la littérature scientifique, analyses des bases de données médico-administratives.
L’année 2017 a essentiellement été consacrée à l’élaboration de la méthodologie permettant de déterminer quels sont les événements indésirables attendus et acceptables au regard du bénéfice de l’acte thérapeutique étudié. Ce travail devra être poursuivi en 2018 avec l’aide d’un groupe de travail composé par des représentants des sociétés savantes et permettra à terme de publier des référentiels de risques dans chaque domaine (stimulation ovarienne, prélèvement d’ovocytes, insémination, transfert, greffe). Ces référentiels permettront aux professionnels de santé de distinguer parmi l’ensemble de ces événements, ceux qui devront faire l’objet d’une déclaration immédiate, d’une surveillance active ou d’un recueil annuel.
Cette clarification du champ permettra de prendre en considération la part de risque inhérente aux activités d’AMP tout en conservant la réactivité nécessaire à la mise en place de mesures correctives lors de l’observation d’événements inacceptables en matière de santé publique ou au regard de la prise en charge individuelle de la donneuse ou du patient/couple concerné.
Bilan des déclarations d’AMP vigilance
I. Chiffres clés
Tableau TAMPV1. Evolution des chiffres clés relatifs à l’AMP vigilance (2013-2017)
|
2013 |
2014 |
2015 |
2016 |
2017 |
Déclarations |
469 |
548 |
489 |
477 |
457 |
Centres |
86 |
87 |
82 |
84 |
80 |
Evènements |
469 |
549 |
491 |
479 |
459 |
|
362 |
413 |
364 |
380 |
359 |
|
107 |
134 |
123 |
95 |
96 |
|
0 |
1 |
2 |
2 |
2 |
Délai moyen de déclaration (jours) |
66 |
68 |
53 |
85 |
76 |
Délai médian de déclarations (jours) |
36 |
40 |
27 |
41 |
34 |
Fréquence des événements graves |
76,1% |
79,7% |
76,5% |
88,3% |
82,9% |
Fréquence des effets indésirables graves |
91,7% |
92,3% |
93,2% |
96,9% |
97,2% |
Fréquence des incidents graves |
23,4% |
40,7% |
28,0% |
54,6% |
30,6% |
Déclarations saisies en ligne |
91,5% |
94,7% |
96,7% |
95,4% |
98,9% |
Nombre moyen de déclarations par centre |
5 |
6 |
6 |
6 |
6 |
II. Données générales
Evolution du nombre de déclarations
Entre le 1er janvier 2017 et le 31 décembre 2017, l’Agence de la biomédecine a reçu 457 déclarations d’AMP vigilance provenant de 80 centres d’AMP (79 centres clinico-biologiques et 1 laboratoire d’insémination artificielle). Le nombre de déclarations a pratiquement triplé depuis la mise en place du dispositif en 2008, et est relativement stable depuis 2013. Le nombre de centres d’AMP est également stable avec en moyenne 84 centres déclarants par année, ce qui représente un peu plus de 80% des centres clinico-biologiques et seulement 2% des laboratoires d’insémination artificielle.
En 2017, les 457 déclarations d’AMP vigilance sont réparties en 361 effets indésirables et en 98 incidents. Ces 457 déclarations correspondaient à 459 événements indésirables car 2 déclarations concernaient à la fois un incident et un effet indésirable liés. Il s’agissait de la survenue de syndrome d’hyperstimulation ovarienne associé à une erreur de déclenchement de l’ovulation.
Figure FAMPV1. Evolution du nombre de déclarations d’AMP vigilance et du nombre de centres déclarants de 2013 à 2017
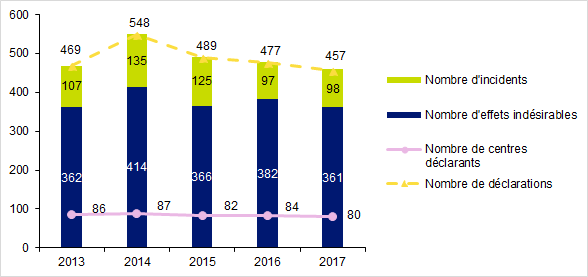
* Déclarations d’événements indésirables adressées à l’Agence de la biomédecine (quelle que soit l’année de constat)
Ce graphique met en évidence que la proportion d’effets indésirables par rapport aux incidents reste stable depuis 2013, avec environ 3/4 d’effets indésirables et 1/4 d’incidents.
Déclaration par centre en 2017
Le nombre moyen de déclarations par centre en 2017 est de 6 ± 5 avec des extrêmes allant de 1 à 32 déclarations. En 2017, 25 centres n’ont pas effectué de déclaration en AMP vigilance, ce qui représente environ 25% des centres d’AMP. Parmi ces 25 centres, 11 centres n’ont jamais ou peu fait de déclarations depuis 2012. Il est prévu de revenir vers eux pour comprendre les raisons de cette sous-notification et les accompagner, le cas échéant, dans la démarche de déclaration et plus globalement de leur gestion des risques.
Délai de déclaration
Concernant les délais de déclaration, le décret n° 2016-1622 du 29 novembre 2016 relatif à l’AMP vigilance prévoit que les Correspondants Locaux d’AMP Vigilance (CLA) déclarent les incidents et les effets indésirables sans délai à l’Agence de la biomédecine ce qui, en pratique, se traduit par un délai de déclaration ne devant pas excéder 48 heures pour les événements graves. Or, le délai moyen entre la déclaration faite à l’Agence de la biomédecine en 2017 et la date de constatation de l’événement indésirable est bien supérieur avec une moyenne de 76 jours [0-693] ± 108 jours et une médiane à 34 jours. Ce délai s’est raccourci par rapport à l’année précédente (moyenne de 85 jours et médiane à 41 jours en 2016). En 2017, 11 événements indésirables ont été déclarés plus d’un an après la date de constatation de l’événement.
Tableau TAMPV2. Répartition des événements indésirables selon le délai entre la constatation et la déclaration de l'événement
Année de la déclaration |
Délai * |
Total |
|||
|
≤ 1 mois** |
] 1 mois - 6 mois] |
] 6 mois - 12 mois] |
≥ 12 mois |
|
2013 |
45,4% |
46,9% |
6,8% |
0,9% |
100% (469) |
2014 |
44,9% |
46,9% |
7,5% |
0,7% |
100% (548) |
2015 |
54,8% |
39,1% |
4,5% |
1,6% |
100% (489) |
2016 |
42,6% |
42,3% |
12,2% |
2,9% |
100% (477) |
2017 |
48,4% |
39,8% |
9,4% |
2,4% |
100% (457) |
* Délai en jours mesuré entre la date à laquelle l'événement indésirable est constaté et la date de la déclaration de cet événement à l'Agence de la biomédecine
** 31 jours
En moyenne, l’Agence de la biomédecine a reçu 38 déclarations par mois, avec deux pics de 51 déclarations en juillet et de 68 déclarations en décembre. En 2017, quasiment la moitié des déclarations ont été envoyées dans le mois qui suit la constatation de l’événement indésirable et près de 12 % des déclarations ont été effectuées plus de 6 mois après la constatation de l’événement.
Données régionales 2017
En 2017, 80 centres d’AMP (79 centres clinico-biologiques d’AMP ou 1 laboratoires d’IA) répartis dans les 12 régions métropolitaines et 2 DOM ont fait au moins une déclaration d’AMP vigilance. Le nombre de déclarations par région varie de 1 déclaration à 107 déclarations pour l’Ile de France.
Figure FAMPV2. Répartition des déclarations d'AMP vigilance par région en 2017
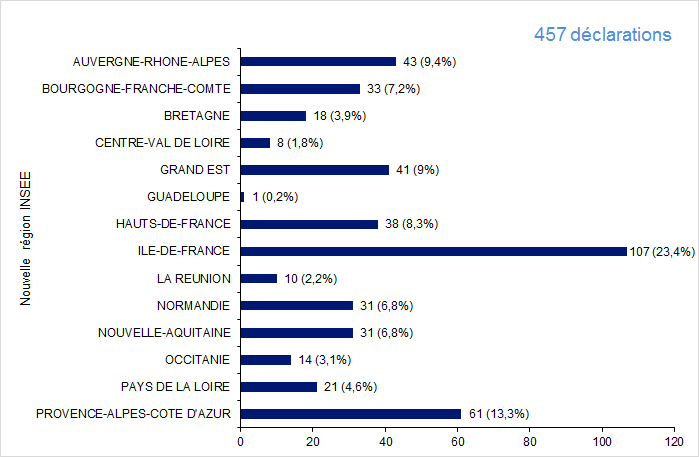
Pour 5 régions, la totalité des centres clinico-biologiques de la région ont fait au moins une déclaration d’AMP vigilance en 2017 (Bourgogne Franche Comté, Guadeloupe, Réunion, Normandie, PACA). Il convient de noter que ces chiffres restent très faibles en regard de l’activité de ces centres.
Ce graphique représente uniquement l’activité déclarative en AMP vigilance. La prise en compte de l’activité de la région montrerait probablement une répartition différente. En effet, Les régions ayant une forte activité en AMP n’ont pas proportionnellement le plus fort taux de notification en vigilance
III. Effets indésirables
Taux de notification des effets indésirables par classe d’activité
Tableau TAMPV3. Evolution du nombre de déclarations d’effets indésirables selon les classes d’activité (AMP, Autoconservation, Don)
|
2015 |
2016 |
2017 |
||
Activité |
Nombre d'actes d'AMP (a) |
Nombre d'effets indésirables |
Nombre d'actes d'AMP(a) |
Nombre d'effets indésirables |
Nombre d'effets indésirables |
AMP |
145255 |
357 |
147730 |
375 |
348 |
Inséminations |
54167 |
6 |
52368 |
7 |
6 |
Fécondations (FIV, ICSI) |
62230 |
326 |
62623 |
346 |
318 |
TEC |
28858 |
7 |
32739 |
8 |
5 |
Type d'AMP non renseigné |
0 |
12 |
0 |
5 |
19 |
Autoconservations |
12287 |
3 |
12792 |
3 |
9 |
Préservation de la fertilité (b) |
5911 |
. |
6473 |
. |
. |
En cours d'AMP (c) |
6376 |
. |
6319 |
. |
. |
Dons (gestion des donneurs) |
795 |
6 |
1109 |
4 |
4 |
Donneurs de spermes |
255 |
0 |
363 |
0 |
1 |
Donneuses d'ovocytes |
540 |
6 |
746 |
4 |
3 |
(a) Tentatives : cycles d'insémination artificielle (IIU, IIC) ; ponctions d'ovocytes dans le cadre des fécondations in vitro (FIV, ICSI) ; mises en fécondation d’ovocytes (don d’ovocytes) ; décongélations d'embryons (TEC).
(b) Il s’agit des nouvelles autoconservations de tissus germinaux quelles qu’elles soient (autoconservations de spermatozoïdes, ovocytes, tissus testiculaires et ovariens réalisées dans l’année (en nombre de patients)).
(c) Il s’agit des nouvelles autoconservations de l’année de tissus germinaux, de spermatozoïdes et d’ovocytes (en nombre de patients).
En AMP, en moyenne, au niveau national, si on rapporte le nombre d’effets indésirables déclarés à l’activité, on obtient un indicateur de 2,46 effets indésirables déclarés pour 1000 actes d’AMP en 2015, de 2,54‰ en 2016 et de 2,36‰ en 2017 (rapporté à l’activité de 2016).
Dans l’activité de don, on obtient, en moyenne, un indicateur de 1,1 effets indésirables pour 100 donneuses en 2015, de 0,5% en 2016 et de 0,4% en 2017. Il convient de rappeler que la survenue d’effets indésirables dans le cadre d’un don est d’autant moins acceptable que cet acte ne confère à la donneuse aucun bénéfice individuel direct. Ces taux sont à comparer aux données de la littérature internationale qui font mention de la survenue de complications sévères allant de 0,11% à 1,03% avec une moyenne à 0,7% et de complications mineures (ayant justifié une consultation médicale) pouvant aller jusqu’à 8,5%.
Répartition des effets indésirables selon le type d’effet indésirable
En 2017, la typologie des effets indésirables a été revue et remplacée par une typologie selon le thesaurus MedDRA (Medical Dictionary for Regulatory Activities) qui est une terminologie médicale utilisée, notamment, dans la codification des effets indésirables déclarés en pharmacovigilance.
En 2017, chaque effet indésirable a été recodé selon cette terminologie en choisissant un terme spécifique qui se rapporte à un symptôme, une maladie ou un diagnostic (PT ou LLT) et un terme plus général comme la « discipline médicale » (SOC). Un PT/LLT pouvant être rattaché à plusieurs SOCs, il a été décidé, pour cette année, de prendre en compte 2 SOCs au maximum. Par exemple une salpingite sera comptabilisée à la fois dans les organes de reproduction et dans les infections.
Répartition des effets indésirables selon les grandes catégories médicales (SOCs)
En prenant en compte le fait que certains effets indésirables se retrouvent dans plusieurs catégories, on remarque qu’en 2017, les effets indésirables concernent majoritairement 3 grandes disciplines médicales : les affections des organes de reproduction et du sein (71% des déclarations), les affections vasculaires (23%), et les infections et infestations (7%).
Figure FAMPV3. Répartition des effets indésirables en 2017 selon les grandes catégories médicales (SOCs)
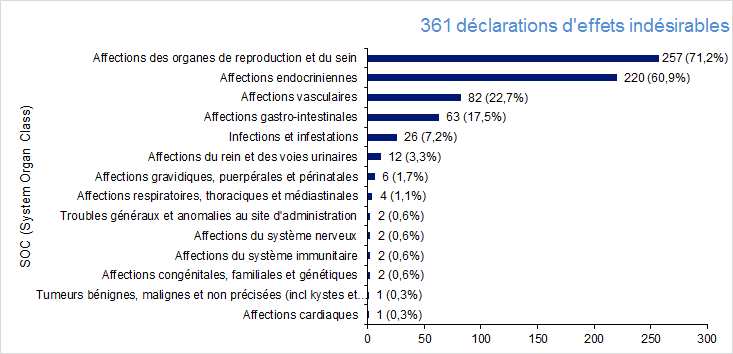
L’ensemble des effets indésirables relatifs aux affections endocriniennes est également compris dans les affections des organes de la reproduction car il s’agit uniquement des syndromes d’hyperstimulation. De la même manière, la majorité des affections gastro-intestinales correspondent également à des affections
vasculaires car il s’agit principalement d’hémopéritoines post-ponctions ovariennes. La plupart des infections se retrouvent également à la fois dans les infections et dans les affections des organes de la reproduction.
Répartition des effets indésirables relatifs aux affections des organes de reproduction et du sein
Figure FAMPV4. Répartition des effets indésirables relatifs aux affections des organes de reproduction et du sein en 2017
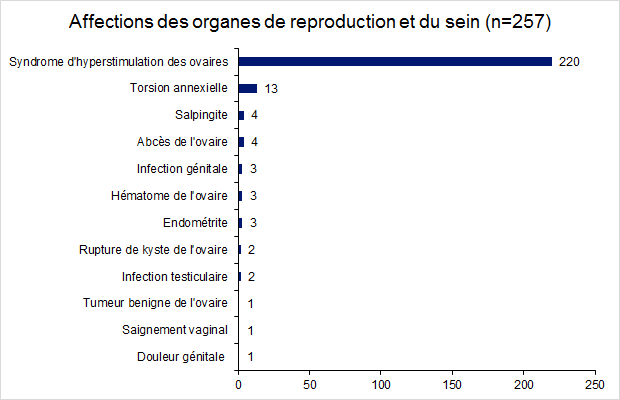
Hormis les infections et les affections vasculaires qui seront détaillées par la suite, les effets indésirables relatifs aux organes de la reproduction sont principalement les syndromes d’hyperstimulation ovarienne (HSO) et les torsions d’annexe qui représentent respectivement 61% (220/361) et 4% (13/361) des déclarations. On observe une légère diminution de la proportion des HSO en 2017 par rapport à 2016 (65% de HSO).
Répartition des effets indésirables relatifs aux infections et infestations
Figure FAMPV5. Répartition des effets indésirables relatifs aux infections et infestations en 2017
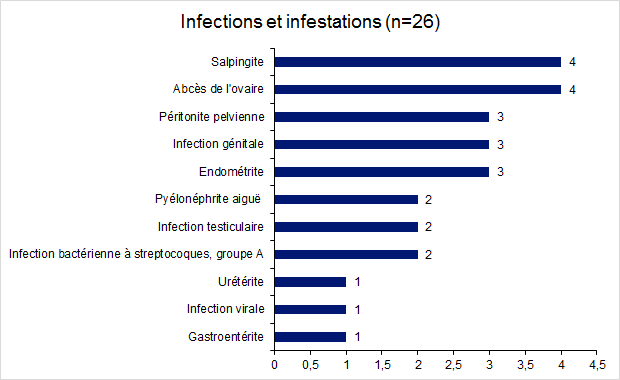
En 2017, environ 7 % des déclarations d’effets indésirables concernent des complications infectieuses (26/361). Ces événements infectieux au décours de ponctions folliculaires concernent principalement des infections liées aux organes de reproduction (abcès de l’ovaire, salpingites/pyosalpinx, endométriomes surinfectés) qui pour une partie surviennent sur un terrain à risque (endométriose, hydrosalpinx, …). Dans quelques cas, il s’agit d’infections liées au système gastro-intestinal (pelvipéritonite) ou au système rénal et urinaire (pyélonéphrite, urétérite). Par rapport à l’année précédente, on observe une augmentation d’environ 2% de ces complications infectieuses.
Les différentes déclarations relatives aux infections mettent en exergue l’hétérogénéité des pratiques selon les centres en terme de décontamination et d’antibioprophylaxie ou antibiothérapie selon les actes et les facteurs de risque. Une réflexion sur cette thématique sera soumise à l’avis du comité de vigilance en AMP.
Répartition des effets indésirables relatifs aux affections vasculaires
Figure FAMPV6. Répartition des effets indésirables relatifs aux affections vasculaires en 2017
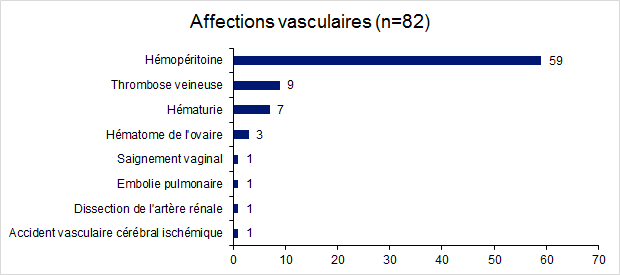
En 2017, les affections vasculaires représentent 23 % (82 cas) des effets indésirables déclarés. Il s’agit dans la majorité des cas d’hémopéritoines post-ponction ovariennes. Ces hémopéritoines représentent 72% des affections vasculaires déclarées et 16 % des effets indésirables déclarés (vs 12% en 2016).
Onze cas d’accidents thromboemboliques, associés pour 6 d’entre eux à un syndrome d’hyperstimulation ovarienne sévère, ont été rapportés par 11 centres d’AMP chez des femmes âgées en moyenne de 36 ± 4 ans [28-42].
Ces 11 cas sont répartis en :
- 1 embolie pulmonaire ;
- 6 thromboses veineuses (membres inférieurs, surale, poplitée, jugulaire) ;
- 2 thromboses veineuses superficielles post pose de perfusion dont une surinfectée ;
- 1 thrombophlébite cérébrale survenue un mois et demi après une insémination sur une grossesse quadruple suite à une 2ème IIU ;
- 1 accident vasculaire cérébral ischémique.
Autres effets indésirables
Le détail des autres effets indésirables moins fréquents est représenté dans le tableau TAMPV4.
Certains effets indésirables apparaissent deux fois car ils appartiennent à 2 SOCs différents (ex : malformation fœtale, œdème aigu du poumon…).
Tableau TAMPV4. Répartition des autres effets indésirables
MEDDRA_SOC |
MEDDRA_PT_LLT |
Nombre de déclarations |
Affections cardiaques |
Œdème aigu du poumon |
1 |
Affections congénitales, familiales et génétiques |
Malformation fœtale |
1 |
Syndrome de Poland |
1 |
|
Affections du rein et des voies urinaires |
Dissection de l'artère rénale |
1 |
Insuffisance rénale aiguë |
1 |
|
Urétérite |
1 |
|
Pyélonéphrite aiguë |
2 |
|
Hématurie |
7 |
|
Affections du système immunitaire |
Choc anaphylactique |
1 |
Érythème noueux |
1 |
|
Affections du système nerveux |
Accident vasculaire cérébral ischémique |
1 |
Inflammation du système nerveux central |
1 |
|
Affections gastro-intestinales |
Gastroentérite |
1 |
Péritonite pelvienne |
3 |
|
Hémopéritoine |
59 |
|
Affections gravidiques, puerpérales et périnatales |
Fausse couche |
1 |
Grossesse multiple |
1 |
|
Hydramnios |
1 |
|
Malformation foetale |
1 |
|
Grossesse extra-utérine rompue |
2 |
|
Affections respiratoires, thoraciques et médiastinales |
Embolie pulmonaire |
1 |
Épanchement pleural isolé |
1 |
|
Laryngospasme |
1 |
|
Œdème aigu du poumon |
1 |
|
Troubles généraux et anomalies au site d'administration |
Réaction indésirable à un médicament |
2 |
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes) |
Tumeur bénigne de l'ovaire |
1 |
Gravité / Conséquences
La gestion des déclarations d’effets indésirables par l’Agence de la biomédecine est notamment basée sur leur niveau de gravité.
Il existe 5 niveaux de gravité allant de G1 à G5, les niveaux G3 à G5 correspondant à des événements indésirables avec des conséquences graves.
Figure FAMPV7. Nombre de déclarations par niveau de gravité (G1 à G5) en 2017
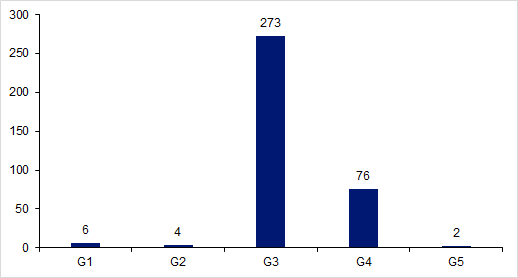
En 2017, les effets indésirables graves (gravité G3 et au-delà) représentent 97,2% (n=351) des effets rapportés. Un effet indésirable est considéré comme grave s’il est susceptible d’entraîner la mort ou de mettre la vie en danger, d’entraîner une invalidité ou une incapacité, de provoquer ou de prolonger une hospitalisation ou tout autre état morbide ou susceptible de se reproduire chez un ou plusieurs donneurs ou personnes qui ont recours à l’AMP ou personnes qui en sont issues. Cette proportion importante d’effets indésirables graves est directement liée au nombre important d’HSO avec hospitalisation déclarées.
Depuis plusieurs années, on observe une augmentation progressive dans la proportion d’effets indésirables graves par rapport aux non graves.
Le type de conséquences pour les 361 effets indésirables observés chez le patient est présenté au tableau TAMPV5.
Tableau TAMPV5. Conséquences des effets indésirables chez les patients concernés (2017)
|
N |
Incapacité Invalidité |
Décès |
Hospitalisation et mise en jeu du pronostic vital |
18 |
2 |
0 |
Hospitalisation sans mise en jeu du pronostic vital |
311 |
11 |
0 |
Aucune hospitalisation |
9 |
0 |
0 |
Hospitalisation inconnue |
23 |
0 |
0 |
Total (événements chez le patient) |
361 |
13 |
0 |
Parmi les 361 déclarations d’effets indésirables, la plupart (329/361 soit 91%) ont entraîné une hospitalisation. Pour 6 % des déclarations d’effet indésirable, l’information concernant l’hospitalisation n’a pas été renseignée. Parmi les cas d’hospitalisation, environ 5% (18/329) ont été déclarés comme pouvant mettre en jeu le pronostic vital avec pour conséquences dans 2 cas une incapacité/invalidité.
Les durées d’hospitalisation en fonction du type d’effet indésirable sont présentées dans le tableau TAMPV6.
Tableau TAMPV6. Durée d'hospitalisation (jours) selon le type d'effet indésirable en 2017
Type d’effet indésirable |
N* |
Moyenne |
Écart-type |
Médiane |
Syndrome d'hyperstimulation des ovaires |
212 |
5,6 |
4 |
5 |
Hémopéritoine |
51 |
3,2 |
2,3 |
2 |
Torsion annexielle |
11 |
2 |
0,8 |
2 |
Thrombose veineuse |
8 |
8,7 |
5 |
9 |
Hématurie |
4 |
1,8 |
0,5 |
2 |
Salpingite |
4 |
5,8 |
2,2 |
5 |
Abcès de l'ovaire |
3 |
8 |
5,6 |
9 |
Endométrite |
3 |
7,7 |
4,5 |
8 |
Hématome de l'ovaire |
3 |
3,3 |
1,2 |
4 |
Infection génitale |
3 |
3 |
2,8 |
3 |
Péritonite pelvienne |
3 |
5,3 |
0,6 |
5 |
Grossesse extra-utérine rompue |
2 |
3 |
0 |
3 |
Infection bactérienne à streptocoques, groupe A |
2 |
10,5 |
6,4 |
10,5 |
Pyélonéphrite aiguë |
2 |
5,5 |
0,7 |
5,5 |
Rupture de kyste de l'ovaire |
2 |
3 |
1,4 |
3 |
Accident vasculaire cérébral ischémique |
1 |
18 |
0 |
18 |
Douleur génitale |
1 |
3 |
0 |
3 |
Embolie pulmonaire |
1 |
7 |
0 |
7 |
Épanchement pleural isolé |
1 |
3 |
0 |
3 |
Fausse couche |
1 |
2 |
0 |
2 |
Gastroentérite |
1 |
1 |
0 |
1 |
Hydramnios |
1 |
2 |
0 |
2 |
Infection virale |
1 |
2 |
0 |
2 |
Inflammation du système nerveux central |
1 |
NR** |
0 |
0 |
Insuffisance rénale aiguë |
1 |
3 |
0 |
3 |
Laryngospasme |
1 |
NR** |
0 |
0 |
Oedème aigu du poumon |
1 |
6 |
0 |
6 |
Réaction indésirable à un médicament |
1 |
1 |
0 |
1 |
Saignement vaginal |
1 |
1 |
0 |
1 |
Tumeur benigne de l'ovaire |
1 |
12 |
0 |
12 |
Urétérite (PT) |
1 |
3 |
0 |
3 |
Total |
329 |
5,1 |
3,9 |
4 |
* Nombre d’effets indésirables avec hospitalisation
** NR : non renseigné
Parmi les 329 déclarations d’effets indésirables ayant entraîné une hospitalisation, la durée d’hospitalisation a été renseignée pour 314 effets. Pour l’ensemble des effets indésirables, la durée moyenne d’hospitalisation a été d’environ 5,1 jours avec une médiane à 4 jours.
Les durées moyennes d’hospitalisation les plus longues s’observent principalement dans les cas d’accidents thromboemboliques (thromboses, AVC) et les complications infectieuses (endométriomes surinfectés, infection bactérienne à streptocoques du groupe A). Le cas d’accident vasculaire cérébrale et de la découverte d’une tumeur bénigne ont entrainé respectivement une hospitalisation d’une durée de 18 jours et de 12 jours.
Parmi les 212 syndromes d’hyperstimulation ovarienne avec hospitalisation, 6 ont entrainé une hospitalisation d'une journée et 199 une hospitalisation de plus d'une journée. Pour 7 déclarations, la durée d’hospitalisation n’avait pas été renseignée.
D’après les données enregistrées dans l’outil AMP Vigie, ces effets indésirables ont généré de façon cumulée un nombre total de 1608 journées d’hospitalisation.
L’évolution clinique finale des effets indésirables est présentée dans la figure FAMPV8.
Figure FAMPV8. Evolution clinique finale des effets indésirables en 2017
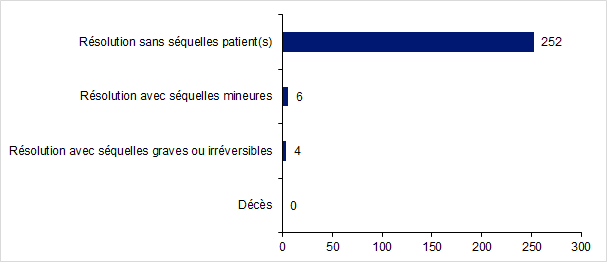
En 2017, pour 73% des déclarations, l’information concernant l’évolution clinique a été renseignée (262/381). En faisant l’hypothèse que les données non renseignées (n=99) signifient qu’il n’y a pas eu de séquelles, l’évolution a été favorable pour 97% des déclarations. Par ailleurs, 6 patientes ont eu une résolution avec des séquelles mineures et 4 patientes ont eu une résolution avec séquelles graves ou irréversibles (ovariectomie bilatérale, hystérectomie, salpingectomie...).
Imputabilité
Figure FAMPV9. Répartition des effets indésirables selon le niveau d'imputabilité lié aux activités d’AMP en 2017 (n=361)
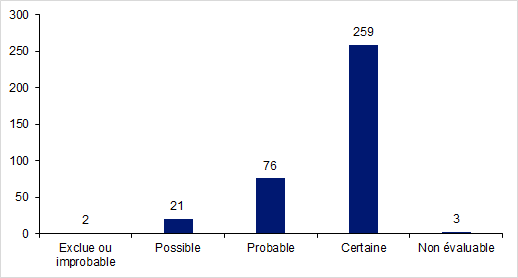
L’imputabilité des effets indésirables déclarés a été cotée le plus souvent comme certaine (72%) en raison d’un lien fréquent entre l’activité d’AMP et la survenue de l’effet indésirable. Il s’agit principalement des cas de syndromes d’hyperstimulation ovarienne.
Deux effets indésirables ont été considérés comme « exclue/improbable ». Il s’agissait dans un cas d’une possible intolérance au Vivelledot dans le cadre d’un TEC et dans l’autre cas d’une rupture prématurée des membranes sur hydramnios à 25SA avec décès de l’enfant à la naissance.
Actions entreprises par le centre
En 2017, le bilan des déclarations montre que des mesures correctives ont été mises en place par 12 centres d’AMP sur les 72 centres ayant déclarés un effet indésirable, ce qui représente seulement 5% des déclarations d’effets indésirables (18/361). Il est à noter que ce chiffre reste stable et faible depuis plusieurs années (6% en 2016) et pourrait être le reflet de la part importante d’effets déclarés considérés comme « attendus et inévitables » et donc n’appelant pas la mise en œuvre de mesures correctives au regard de la pratique ou de l’état de santé du patient.
Toutefois, avec la mise en place du rapport d’activité d’AMP vigilance par centre, on peut noter qu’il existe surtout une réflexion plus globale sur la prévention de ces effets indésirables car une soixantaine de centres d’AMP ont renseigné dans leur rapport avoir mis en place des actions correctives suite à des effets indésirables. Ces actions sont ciblées principalement sur les 2 effets indésirables les plus fréquents que ce sont les syndromes d’hyperstimulation ovarienne et les hémopéritoines.
Par ailleurs, dans les déclarations, certains centres ont signalé avoir transmis leurs déclarations à une autre vigilance. En 2017, 21% des déclarations d’effets indésirables (77/361), ont fait l’objet d’un signalement à une autre vigilance. Parmi ces déclarations, la majorité d’entre elles ont concerné une déclaration en pharmacovigilance (en lien avec les HSO).
Activité de don ou événement donneur
Activité de don
En 2017, l’Agence a reçu une déclaration relative au diagnostic d’un syndrome de Poland chez un enfant de 5 ans né suite à une ICSI et une déclaration relative à une malformation fœtale (pieds bots et retard de croissance intra-utérin) chez un couple receveur (don de sperme).
L’analyse individuelle de ce type de déclaration est peu contributive pour la mise en œuvre de mesure corrective, néanmoins, l’élargissement du champ de l’AMP vigilance aux personnes issues d’un acte d’AMP était essentiel pour pouvoir aborder les mesures de minimisation des risques dès lors qu’un signal péjoratif significatif (différence significative de survenue d’un événement indésirable lors d’une étude de cohorte ou cas/témoins) est observé dans des études populationnelles.
Evénement donneur
Parmi les 361 effets indésirables, 3 déclarations concernaient des donneuses d’ovocytes. Il s’agissait de 3 hémopéritoines. Parmi ces 3 déclarations, toutes ont été considérées comme sévères. Le taux d’effets indésirables chez les donneuses d’ovocytes observé en 2017 rapporté à l’activité 2016 est de 0,4%, ce qui reste comparable aux données de la littérature scientifique.
IV. Incidents
Parmi les 457 déclarations d’événements indésirables, l’Agence a reçu 98 déclarations d’accidents ou d’erreurs dont 31% étaient considérés par les déclarants comme étant des incidents graves (n=30).
Répartition des incidents par étape du processus
En 2017, un nouveau thesaurus des incidents a été élaboré en se basant sur les étapes de survenue de l’incident. L’objectif de cette classification est de permettre d’identifier l’étape la plus en amont dans le processus (cause racine) ayant fait l’objet d’une défaillance et de cibler le plus précisément possible à quelle étape il est nécessaire de mettre en place des actions correctives.
Figure FAMPV10. Répartition des incidents par étape de survenue (2017)
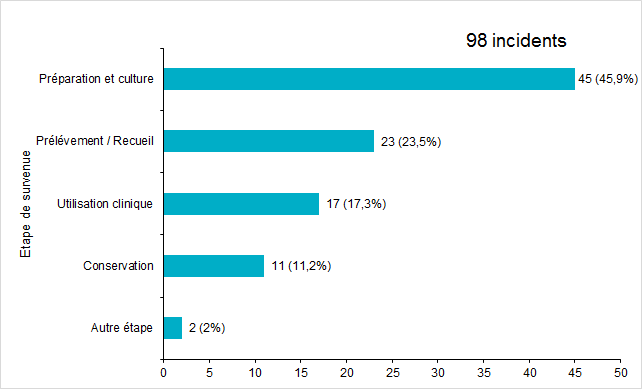
Les 2 étapes du processus apparaissant comme les plus à risque d’incidents sont la préparation et la culture des gamètes/embryons (46% des incidents) et le recueil / prélèvement des gamètes (23% des incidents).
Une analyse plus détaillée est présentée par la suite dans les figures FAMPV11 à FAMPV15.
Répartition des incidents par sous-étape du processus
Chaque étape du processus a été divisée en sous-étapes afin d’être le plus précis possible dans l’analyse et l’identification de l’origine de l’incident.
Figure FAMPV11. Répartition des incidents pour l’étape de préparation et de culture

En 2017, les incidents au cours de la préparation et de la culture des gamètes, embryons, tissus germinaux représentent quasiment la moitié des déclarations d’incidents (45,9%).
A l’étape de réception des gamètes au laboratoire, seulement deux incidents ont été déclarés et concernaient dans un cas une maladresse (faux mouvement) entrainant le renversement des tubes de ponction ovocytaire sur la paillasse et dans l’autre cas un défaut de réglage de température du bain-marie contenant les tubes de ponctions au laboratoire.
A l’étape de préparation des gamètes, embryons, tissus germinaux, les incidents qui surviennent sont essentiellement des erreurs de manipulation ou d’inattention telles que la chute ou la destruction accidentelle de boites de culture, l’oubli de boites dans un incubateur, l’utilisation de sérum physiologique à la place d’eau stérile lors de la mise en œuvre du test de gonflement hypo-osmotique, une erreur de préparation des milieux de décoronisation ovocytaire, une erreur de volume pipeté de milieu de culture,…
A l’étape de culture des gamètes, embryons, tissus germinaux, les incidents déclarés concernent pour la moitié des incidents en lien avec le matériel (ex : incubateur en alarme due à un défaut d’alimentation électrique ou à un défaut d’approvisionnement en CO2, porte de l’étuve mal refermée) et pour l’autre moitié des incidents relatifs à une contamination des cultures embryonnaires. L’origine de ces contaminations est répartie de la façon suivante : 1/3 spermatique (E.Coli), 1/3 manuportée (Staphylocoque hominis) et 1/3 liée à l’environnement (Bukholderia cepacia, Brevundimonas diminuta).
L’étape de congélation concerne 15 % des incidents de préparation. Il s’agit essentiellement de pertes avérées ou potentielles d’embryons en lien avec du matériel (ex : stripper défectueux, difficulté de montage de l’embryon dans la paillette, arrêt du congélateur suite à une coupure d’alimentation électrique), de l’utilisation d’un kit de dévitrification au lieu du kit de vitrification ou de l’oubli de congélation d’un embryon.
L’étape de décongélation concernent la même proportion de déclarations qu’au moment de la congélation (n=7). Il s’agissait de décongélation d’embryons n’ayant pas abouti au transfert d’embryon congelé du fait par exemple de l’oubli par la patiente de la prise des ovules de progestérone, du résultat de progestéronémie transmis trop tardivement, d’une erreur sur la date de décongélation, de la perte d’embryon au moment du passage dans le bain de rinçage.
Au conditionnement final, un seul incident nous a été signalé. Il s’agissait d’un oubli d'autoconservation pour une donneuse nullipare. L’ensemble des 18 ovocytes obtenus a été attribué à deux receveuses alors que la donneuse souhaitait une autoconservation.
Figure FAMPV12. Répartition des incidents pour l’étape de prélèvement et recueil
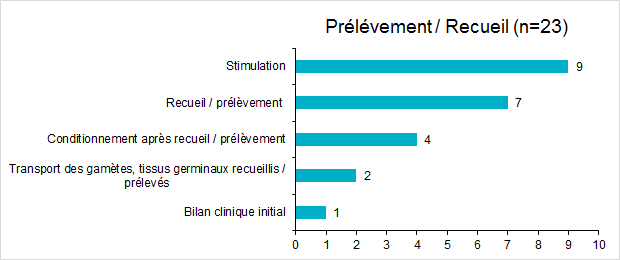
En 2017, les incidents au cours du prélèvement / recueil représentent environ un quart des déclarations d’incidents (23,5%). A l’étape du prélèvement, les étapes qui semblent le plus à risque d’incident sont la stimulation et le recueil qui représentent respectivement 39% et 30% des incidents relatifs au prélèvement.
Les incidents lors de la stimulation correspondaient principalement à des erreurs de déclenchement (erreur de produit, erreur de jour de déclenchement, administration de la mauvaise dose, inefficacité du déclenchement) entrainant souvent des ponctions blanches et à quelques erreurs dans le protocole de stimulation (administration simultanée de décapeptyl et de FSH, erreur d’administration dans un contexte de changement de protocole).
A l’étape de recueil / prélèvement, 7 incidents ont été déclarés. Il s’agissait d’incidents de type organisationnel (ex : retard de la ponction suite à l’occupation du bloc opératoire), de maladresse (seringue de ponction trop remplie avec perte de liquide pendant le transport, chute de la boite d’ovocytes), de contaminations (sperme ou liquide de ponction contaminé le jour du recueil) ou de défaut de matériel (seul échographe de ponction hors service, défaillance de la pompe d’aspiration utilisée au moment de la ponction).
D’autres incidents concernaient l’étape du bilan clinique initial, du conditionnement et du transport tels que le refus d’anesthésie le jour de la ponction pour défaut de consultation pré-anesthésique, une absence ou un défaut d’étiquetage des tubes de liquide folliculaire, le dysfonctionnement de la mallette de transport (température très élevée, mallette éteinte).
Figure FAMPV13. Répartition des incidents pour l’étape d’utilisation clinique
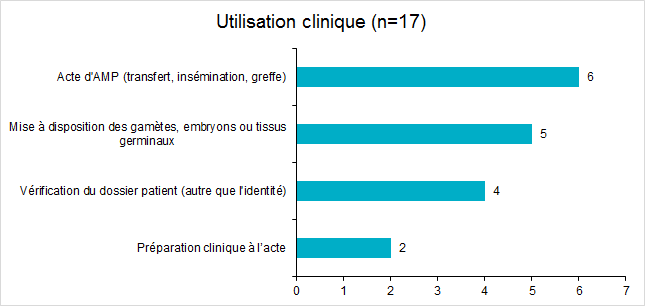
En 2017, les incidents au cours de l’utilisation clinique (transfert, insémination, greffe) représentent 17,3% des déclarations d’incidents.
La mise à disposition des gamètes, embryons et tissus germinaux (ex : chute de la boite de transfert contenant les embryons ou chute du cathéter) et l’acte d’AMP en lui-même (ex : désolidarisation de la seringue du cathéter, changement de cathéter et perte de l’embryon, erreur d’attribution d’embryon) sont les étapes qui semblent les plus à risque de ce processus.
Quelques déclarations étaient relatives à la vérification du dossier patient (ex : absence de vérification des sérologies préalables au transfert, non-respect des procédures de vérification des voyages en zone d’épidémie au virus Zika) et à la préparation clinique à l’acte (erreur de programmation d’un TEC, totalité du stylo d’ovitrelle administré au lieu de 6 clic pré-transfert).
Figure FAMPV14. Répartition des incidents pour l’étape de conservation
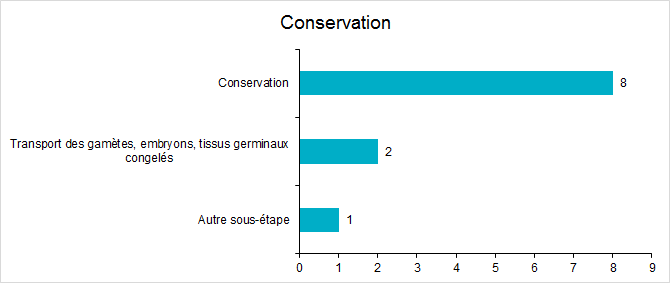
En 2017,11% des incidents concernaient des problématiques relatives à la conservation.
Il s’agissait pour la moitié de défaut matériel de type mise en maintenance non intentionnelle des cryobanques (bug informatique supposé), d’un défaut d’alimentation de la cuve par le fournisseur d'azote liquide (différentiel observé du niveau d’azote entre le fournisseur (27%) et la mesure locale (<10%)), le déclenchement d’une alarme de niveau dans un réservoir cryogénique à remplissage automatique possiblement en lien avec la présence de copeaux de limaille dans le corps de l'électrovanne ou le décollement d’étiquettes sur des paillettes dans une cuve d’azote.
Pour l’autre moitié, il s’agissait de maladresses, d’erreurs humaines telles que la chute de paillettes sur le sol au décours de la manipulation d’une cuve, la découverte de 3 paillettes cassées au fond d’une cuve (probablement en lien avec le couvercle du gobelet cryogénique peu stable) ou la découverte d'une cuve d'azote liquide laissée ouverte avec un canister accroché au niveau du col de la cuve.
Les incidents survenus aux étapes de transport concernaient un défaut de rangement des paillettes dans un container et un réchauffement du container.
La figure FAMPV15 permet de visualiser à gauche les étapes du processus d’AMP et à droite les sous-étapes. L’épaisseur de la bande est proportionnelle au nombre d’incidents survenus à chaque étape.
Figure FAMPV15. Répartition des incidents selon l’étape et la sous-étape de survenue (2017)
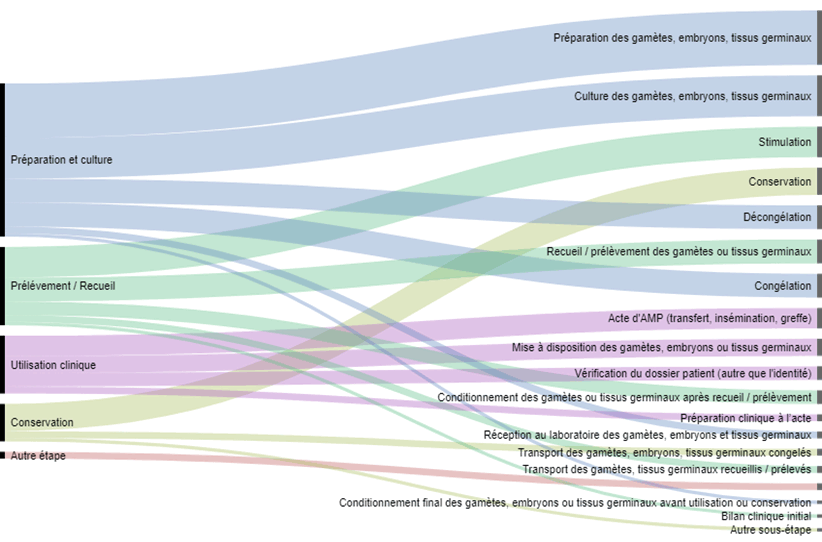
Les 4 sous-étapes pour lesquelles il y a eu un nombre plus important d’incidents sont dans l’ordre:
- La préparation des gamètes, embryons, tissus germinaux
- La culture des gamètes, embryons, tissus germinaux
- La stimulation
- La conservation
Cette représentation sous forme de processus permet de voir que les incidents surviennent à toutes les étapes de ce processus qu’elles soient biologiques ou cliniques.
Répartition des incidents par cause
Un thesaurus des causes a été mis en place en 2017 et sera accessible aux professionnels dans la prochaine version d’AMP Vigie.
La répartition des incidents déclarés en 2017 selon la cause de survenue est représentée à la figure FAMPV16.
Figure FAMPV16. Répartition des incidents selon la cause de survenue (2017)
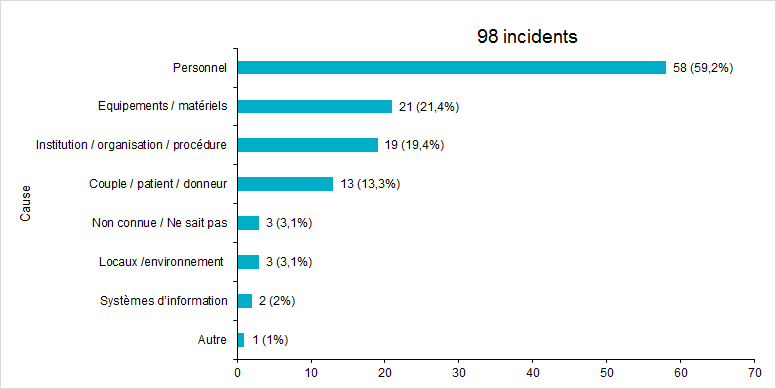
En 2017, dans presque 60% des cas, l’incident est en rapport avec un accident ou une erreur lié au personnel.
Les 3 causes les plus fréquentes à l’origine des incidents sont :
- Le personnel (maladresse, difficulté ou erreur liée à la gestuelle technique) (59%)
- Les équipements et le matériel défectueux (21%)
- L’institution / organisation / procédure (19%)
La répartition des 3 causes les plus fréquentes selon les étapes du processus est représentée aux figures FAMPV17 à FAMPV19.
Figure FAMPV17. Répartition des incidents relatifs au personnel selon les étapes du processus
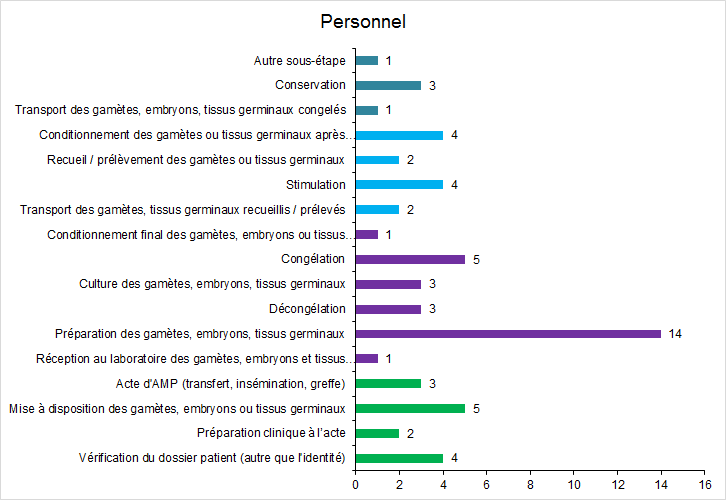
En 2017, les erreurs ou accidents liés au personnel concernent principalement la préparation des gamètes, la congélation et la mise à disposition des embryons ou gamètes au moment du transfert ou de l’insémination. Il s’agit d’étapes pour lesquelles il y de nombreuses manipulations par l’humain. Ces accidents peuvent s’expliquer par une technicité accrue des méthodes de préparation des gamètes ou embryons augmentant les risques, par des maladresses du personnel parfois en relation avec une surcharge d’activité mais également par une meilleure notification de ces événements. Dans la très forte majorité des cas, il s’agit d’incidents isolés et le plus souvent multifactoriels.
Figure FAMPV18. Répartition des incidents relatifs à des équipements / matériels défectueux selon les étapes du processus

Les causes « Matériel » se retrouvent essentiellement lors de la culture et de la conservation des gamètes, embryons et tissus germinaux. Il s’agit en effet d’étapes nécessitant l’utilisation quotidienne d’équipements parfois vétustes ou insuffisamment sécurisés tels que les incubateurs et les récipients cryogéniques.
Figure FAMPV19. Répartition des incidents relatifs à l’organisation selon les étapes du processus
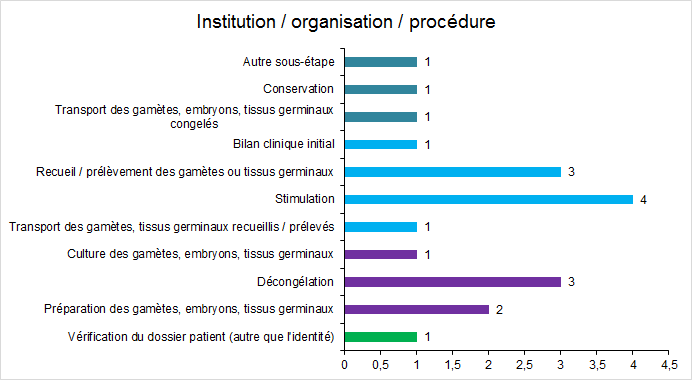
Les incidents ayant pour cause un dysfonctionnement dans l’organisation ou un défaut de procédure surviennent essentiellement sur des activités cliniques (stimulation et recueil) et lors de la décongélation.
Erreurs d’identification / erreurs d’attribution
En 2017, 9 erreurs d’identification ont été déclarées. Ces déclarations concernaient 4 erreurs d’étiquetage des tubes de liquides folliculaires ou de recueil de sperme, 1 erreur de préparation de sperme entre deux donneurs, 1 décongélation inappropriée d’un embryon et 3 erreurs d’attribution d’embryon lors d’un transfert.
Conséquences
Parmi les 98 incidents déclarés en 2017, 83 déclarations concernaient des gamètes, embryons et tissus germinaux et un peu plus de la moitié de ces déclarations ont eu pour conséquence une perte avérée des gamètes ou embryons (46/83 soit 55%). En 2017, 35 couples étaient concernés par une perte avérée de gamètes, embryons ou tissus germinaux dont plus de 50% étaient concernées par une perte totale de procréation sur la tentative.
Actions entreprises par le centre
En 2017, 30 centres parmi les 42 qui ont déclaré un incident en AMP vigilance ont mis en place des actions correctives, ce qui représente 49% des déclarations d’incidents (48/98). Il s’agissait le plus souvent de la mise en place ou de la modification de procédures.
En 2017, une trentaine de centres nous ont également renseigné dans leur rapport annuel d’activité d’AMP vigilance avoir mis en place des actions correctives suite à des incidents. Dans plus de la moitié des cas (57%), le centre a mis en place des actions de sensibilisation et de formation du personnel (notamment rappel et explications des procédures). Plus de 30% ont précisé avoir mis en place des mesures d’organisation concernant le processus d’AMP. Des actions de type auto-inspection ou audit ont été mises en place pour la moitié de ces centres.
Par ailleurs, dans les déclarations, certains centres ont signalé avoir transmis la déclaration à une autre vigilance. En 2017, 12% des déclarations d’incident (12/98) ont fait l’objet d’un signalement à une autre vigilance. Parmi ces déclarations, la majorité d’entre elles ont concerné une déclaration à un système de déclaration interne à l’hôpital (ex : Osiris, Sapanet...) ou au service d’hygiène hospitalière. Deux déclarations ont été transmises en matériovigilance.
Pour plus d’informations et de détails sur les déclarations, le rapport annuel d’AMP vigilance 2017 adressé au ministre en charge de la santé est téléchargeable à partir de juillet 2018 sur le site de l’Agence de la biomédecine (https://www.agence-biomedecine.fr/AMPVigilance)